题目内容
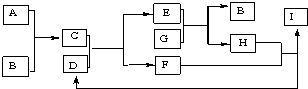
短周期主族元素组成的下列物质,其中A是最轻的金属,B是空气的主要成分,常温时D是无色液体,E、H是无色气体,G是黄绿色气体.
(1)组成G单质的元素在周期表中的位置 ;
(2)写出C+D→E+F的化学方程式 ;
(3)用E、H气体做喷泉实验后,然后取2种溶液等体积混合,混合后离子浓度大小为 ;
(4)AFePO4 可以做电池正极材料,通常可用碳热还原法制备,该法以Fe2O3、AH2PO4和碳作为反应物,在700℃时反应且产生无毒气体,若每转移1mol电子吸收xKJ热量,则热化学方程式为 ;
(5)已知液态E和D的电离相似,推测A和液态E反应的化学方程式 ;
(6)化合物M的组成元素与C完全相同,M中A元素的质量分数约为14%,则M的化学式为 ;
(7)一定条件下,E在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是 (选填序号).

(1)组成G单质的元素在周期表中的位置
(2)写出C+D→E+F的化学方程式
(3)用E、H气体做喷泉实验后,然后取2种溶液等体积混合,混合后离子浓度大小为
(4)AFePO4 可以做电池正极材料,通常可用碳热还原法制备,该法以Fe2O3、AH2PO4和碳作为反应物,在700℃时反应且产生无毒气体,若每转移1mol电子吸收xKJ热量,则热化学方程式为
(5)已知液态E和D的电离相似,推测A和液态E反应的化学方程式
(6)化合物M的组成元素与C完全相同,M中A元素的质量分数约为14%,则M的化学式为
(7)一定条件下,E在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是
| 选项 | a | b | c | d |
| X | 温度 | 温度 | 加入H2的物质的量 | 加入E的物质的量 |
| Y | E的物质的量 | 平衡常数K | E的转化率 | 生成物物质的量总和 |
考点:无机物的推断
专题:推断题
分析:短周期主族元素组成的下列物质,其中A是最轻的金属,则A为Li,B是空气的主要成分,则B是N2,根据框图可知C为Li3N,G是黄绿色气体,则G是Cl2,根据E+G=B+H,E、H是无色气体,所以E为氨气,H为氯化氢,常温时D是无色液体,能与Li3N反应生成氨气,所以D为水,F为LiOH,根据框图知,I为氯化锂,据此答题;
解答:
解:短周期主族元素组成的下列物质,其中A是最轻的金属,则A为Li,B是空气的主要成分,则B是N2,根据框图可知C为Li3N,G是黄绿色气体,则G是Cl2,根据E+G=B+H,E、H是无色气体,所以E为氨气,H为氯化氢,常温时D是无色液体,能与Li3N反应生成氨气,所以D为水,F为LiOH,根据框图知,I为氯化锂,
(1)组成G单质的为氯元素,在周期表中第三周期第ⅦA族,
故答案为:第三周期第ⅦA族;
(2)根据上面的分析可知,C+D→E+F的化学方程式为Li3N+3H2O=3LiOH+NH3↑,
故答案为:Li3N+3H2O=3LiOH+NH3↑;
(3)用E、H气体做喷泉实验后,然后取2种溶液等体积混合,可得氯化铵溶液,由于铵根离子水解,溶液呈酸性,所以混合后离子浓度大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)LiFePO4 可以做电池正极材料,通常可用碳热还原法制备,该法以Fe2O3、LiH2PO4和碳作为反应物,在700℃时反应且产生无毒气体,化学方程式为2Fe2O3(s)+4LiH2PO4(s)+C(s)=4LiFePO4(s)+4H2O(g)+CO2(g),在这个反应中,每摩尔碳参加反应,转移4mol电子,若每转移1mol电子吸收xKJ热量,则热化学方程式为2Fe2O3(s)+4LiH2PO4(s)+C(s)=4LiFePO4(s)+4H2O(g)+CO2(g)△H=+4xKJ/mol,
故答案为:2Fe2O3(s)+4LiH2PO4(s)+C(s)=4LiFePO4(s)+4H2O(g)+CO2(g)△H=+4xKJ/mol;
(5)已知液态NH3和H2O的电离相似,推测Li和液态NH3反应的化学方程式为2Li+2NH3=2LiNH2+H2↑,
故答案为:2Li+2NH3=2LiNH2+H2↑;
(6)化合物由Li和N组成,Li元素的质量分数约为14%,则化合物中Li和N的个数比为
:
=1:3,所以化合物的化学式为LiN3,
故答案为:LiN3;
(7)一定条件下,在固定体积的密闭容器中,由于氨的分解是气体体积增大的吸热反应,所以a升高温度,平衡正向移动,氨的物质的量减小,b升高温度,平衡正向移动,平衡常数增大,c增加氢气的物质的量,平衡逆向移动,氨气的转化率减小,d增加氨气的物质的量,生成物的物质的量也会增加,
故选ac.
(1)组成G单质的为氯元素,在周期表中第三周期第ⅦA族,
故答案为:第三周期第ⅦA族;
(2)根据上面的分析可知,C+D→E+F的化学方程式为Li3N+3H2O=3LiOH+NH3↑,
故答案为:Li3N+3H2O=3LiOH+NH3↑;
(3)用E、H气体做喷泉实验后,然后取2种溶液等体积混合,可得氯化铵溶液,由于铵根离子水解,溶液呈酸性,所以混合后离子浓度大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)LiFePO4 可以做电池正极材料,通常可用碳热还原法制备,该法以Fe2O3、LiH2PO4和碳作为反应物,在700℃时反应且产生无毒气体,化学方程式为2Fe2O3(s)+4LiH2PO4(s)+C(s)=4LiFePO4(s)+4H2O(g)+CO2(g),在这个反应中,每摩尔碳参加反应,转移4mol电子,若每转移1mol电子吸收xKJ热量,则热化学方程式为2Fe2O3(s)+4LiH2PO4(s)+C(s)=4LiFePO4(s)+4H2O(g)+CO2(g)△H=+4xKJ/mol,
故答案为:2Fe2O3(s)+4LiH2PO4(s)+C(s)=4LiFePO4(s)+4H2O(g)+CO2(g)△H=+4xKJ/mol;
(5)已知液态NH3和H2O的电离相似,推测Li和液态NH3反应的化学方程式为2Li+2NH3=2LiNH2+H2↑,
故答案为:2Li+2NH3=2LiNH2+H2↑;
(6)化合物由Li和N组成,Li元素的质量分数约为14%,则化合物中Li和N的个数比为
| 14% |
| 7 |
| 86% |
| 14 |
故答案为:LiN3;
(7)一定条件下,在固定体积的密闭容器中,由于氨的分解是气体体积增大的吸热反应,所以a升高温度,平衡正向移动,氨的物质的量减小,b升高温度,平衡正向移动,平衡常数增大,c增加氢气的物质的量,平衡逆向移动,氨气的转化率减小,d增加氨气的物质的量,生成物的物质的量也会增加,
故选ac.
点评:本题考查无机物的推断,涉及知识点较多,有一定的综合性,题目难度中等,物质的判断是解题的关键,解题时注意把握题目的题眼,灵活运用元素化合物知识.

练习册系列答案
相关题目
下列关于有机物说法正确的是( )
| A、乙醇、乙醛和乙酸都可以与钠反应生成氢气 |
| B、蛋白质水解的最终产物是葡萄糖 |
| C、苯和乙烯都可以使溴的四氯化碳溶液反应褪色 |
| D、可用碘检验淀粉是否水解完全 |
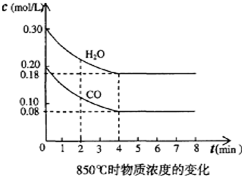 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度变化如图,下列叙述错误的是( )
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度变化如图,下列叙述错误的是( )| A、0一4min的平均反应速率υ(CO2)为0.03mol/(L?min) |
| B、850℃时,平衡常数K=1 |
| C、850℃时,若向该容器中充入1.0 mol CO、1.0 molH2O,则CO的平衡转化率不变 |
| D、容器中气体密度不变不能判断该反应已经达到化学平衡状态 |
今有HA、H2B两种弱酸,有如下关系:H2B+A-=HB-+HA,B2-+HA=HB-+A-,则下列说法正确的是( )
| A、H2B的电离方程式为:H2B?2H++B2- |
| B、结合质子能力由强到弱的顺序为:B2->A->HB-C |
| C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强 |
| D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者 |
下列化学与生活知识中叙述正确的是( )
| A、汽车尾气导致白色污染 |
| B、甲醛是某些劣质装饰板材释放的常见污染物之一 |
| C、酸雨是指pH<7的雨水,主要由于空气中SO2含量偏高引起 |
| D、臭氧空洞的形成与二氧化碳的过量排放有关 |