题目内容
氯气和氨气在常温下混合即可发生反应.某课外小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如下装置.
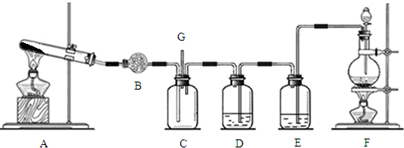
请回答:
(1)装置F中发生反应的离子方程式是 .
(2)装置D中盛放的试剂及其作用是 .
(3)下列装置中可替代装置A的是 (填序号).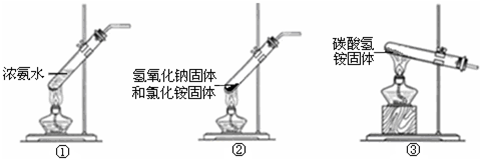
(4)若从装置C的G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 的洗气瓶.

请回答:
(1)装置F中发生反应的离子方程式是
(2)装置D中盛放的试剂及其作用是
(3)下列装置中可替代装置A的是

(4)若从装置C的G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有
考点:氯、溴、碘的性质实验,氨的制取和性质
专题:实验题
分析:(1)实验室用浓盐酸与二氧化锰反应制备氯气;
(2)从F中制得的氯气含有氯化氢和水蒸气杂质,D除去的水蒸气;
(3)根据A装置的特点可知装置A是用固体氯化铵和固体氢氧化钙加热制备氨气;
(4)用氢氧化钠溶液吸收过量的氯气.
(2)从F中制得的氯气含有氯化氢和水蒸气杂质,D除去的水蒸气;
(3)根据A装置的特点可知装置A是用固体氯化铵和固体氢氧化钙加热制备氨气;
(4)用氢氧化钠溶液吸收过量的氯气.
解答:
解:(1)浓盐酸与二氧化锰在加热条件反应生成氯气和氯化锰和水,化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
离子方程式为:MnO2+4 H++2 Cl-
Mn2++Cl2↑+2 H2O,故答案为:MnO2+4 H++2 Cl-
Mn2++Cl2↑+2 H2O;
(2)从F中制得的氯气含有氯化氢和水蒸气杂质,依次通过盛有饱和食盐水的E和盛有浓硫酸的D除去,故答案为:浓硫酸;干燥氯气;
(3)根据A装置的特点可知装置A是用固体氯化铵和固体氢氧化钙加热制备氨气,固体加热试管口应略向下倾斜,②不符合此原理,故答案为:①③;
(4)尾气中含有少量Cl2,为防止其污染环境,可以用盛有氢氧化钠溶液的洗气瓶吸收,反应的方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液.
| ||
离子方程式为:MnO2+4 H++2 Cl-
| ||
| ||
(2)从F中制得的氯气含有氯化氢和水蒸气杂质,依次通过盛有饱和食盐水的E和盛有浓硫酸的D除去,故答案为:浓硫酸;干燥氯气;
(3)根据A装置的特点可知装置A是用固体氯化铵和固体氢氧化钙加热制备氨气,固体加热试管口应略向下倾斜,②不符合此原理,故答案为:①③;
(4)尾气中含有少量Cl2,为防止其污染环境,可以用盛有氢氧化钠溶液的洗气瓶吸收,反应的方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液.
点评:本题考查氯气、氨气的制备和性质实验,题目难度中等,注意把握实验的原理和物质的化学性质.

练习册系列答案
相关题目
工业上用洗净的废铜屑作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采取的方法是( )
| A、Cu+HNO3(浓)→Cu(NO3)2 | |||||
| B、Cu+HNO3(稀)→Cu(NO3)2 | |||||
C、Cu
| |||||
D、Cu
|
能正确表示CH4中碳原子成键方式的电子排布图为( )
A、 |
B、 |
C、 |
D、 |
下列分子或离子中中心原子为用来成键的电子对最多的是( )
| A、NH4+ |
| B、NH3 |
| C、H2O |
| D、BCl3 |
中学常见物质A、B、C、D存在如图转化关系(部分生成物和反应条件略去).该转化关系中A可能是下列物质中的( )A
B
C
①金属钠 ②硫单质 ③NH3 ④Na2CO3 ⑤AlCl3溶液 ⑥单质铁.
| D |
| D |
①金属钠 ②硫单质 ③NH3 ④Na2CO3 ⑤AlCl3溶液 ⑥单质铁.
| A、3 | B、4 | C、5 | D、6 |
等质量的下列物质与足量浓盐酸反应(必要时可加热),放出Cl2物质的量最多的是( )
| A、KMnO4 |
| B、MnO2 |
| C、NaClO3 |
| D、NaClO |
 X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.
X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白. 实验室利用如图中装置制取乙酸异戊酯,其合成过程为:
实验室利用如图中装置制取乙酸异戊酯,其合成过程为: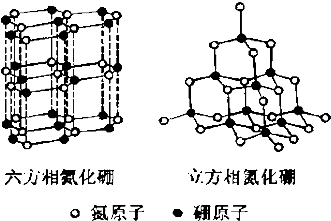 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.