题目内容
3.用石墨电极电解CuCl2溶液(如图).下列分析正确的是( )
| A. | b端是直流电源的负极 | |
| B. | 实验过程中溶液的导电能力没有明显变化 | |
| C. | 通电一段时间后,在阴极附近观察到黄绿色气体 | |
| D. | 若将甲电极换成铁棒,乙电极换成铜棒,则可实现在铁棒上镀铜 |
分析 A、依据图中离子移动方向分析,电解过程中阳离子移向阴极,阴离子移向阳极分析确定电极名称;
B、溶液的导电能力和自由移动离子的浓度大小有关;
C、依据离子移动方向可知阳极是氯离子失电子发生氧化反应;
D、若将甲电极(阴极)换成铁棒,乙电极(阳极)换成铜棒,在阴极上析出铜,在阳极上金属铜质量减小.
解答 解:A、依据图中离子移动方向分析,电解过程中阳离子移向阴极,阴离子移向阳极分析确定电极名称,氯离子移向阳极,则b电极为电源正极,a为电源负极,故A错误;
B、用石墨电极电解CuCl2溶液,铜离子和氯离子浓度在不断地减小,所以溶液的导电能力在减小,故B错误;
C、氯离子在阳极失电子生成氯气,通电一段时间后,在阳极附近观察到黄绿色气体,故C错误;
D、若将甲电极(阴极)换成铁棒,乙电极(阳极)换成铜棒,电解CuCl2溶液,在阴极上析出的是金属铜,在阳极上金属铜质量减小,则可实现在铁棒上镀铜,故D正确.
故选D.
点评 本题考查了电解原理的分析应用,电极分析判断,电极反应分析,离子移动方向的判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
14.陶瓷是传统硅酸盐产品,根据陶瓷的生产原理,可以得出硅酸盐工业的一般特点是( )
①以含硅物质作为原料 ②主要产物是硅酸盐 ③反应条件是高温 ④反应原理是复杂的物理变化和化学变化.
①以含硅物质作为原料 ②主要产物是硅酸盐 ③反应条件是高温 ④反应原理是复杂的物理变化和化学变化.
| A. | 只有①③ | B. | 只有②③ | C. | ①②③④ | D. | 只有③④ |
11.下列有关金属的说法正确的是( )
①铁钉在潮湿的空气容易生锈 ②钠着火用水扑灭 ③铝在空气中耐腐蚀,所以铝是不活泼金属 ④用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高⑤青铜、不锈钢都是合金 ⑥KSCN溶液可以检验Fe3+.
①铁钉在潮湿的空气容易生锈 ②钠着火用水扑灭 ③铝在空气中耐腐蚀,所以铝是不活泼金属 ④用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高⑤青铜、不锈钢都是合金 ⑥KSCN溶液可以检验Fe3+.
| A. | ①④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②⑤⑥ |
8.下列叙述正确的是( )
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) | |
| B. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2 | |
| C. | 常温下,pH=11的NaOH溶液与pH=3的盐酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-):c(NH3•H2O)减小 |
15.将标准状况下2.24L H2S缓缓通入到100mL l mol/L NaOH溶液中充分反应后,溶液中c(H2S)>c(S2-).下列叙述正确的是( )
| A. | 整个过程中,H20的电离度逐渐增大 | B. | c(Na+)>c(HS-)>c(H+)>c(S2-)>c(0H-) | ||
| C. | c(Na+)+c(H+)═c(0H-)+c(HS-)+2c(S2-) | D. | c(Na+)═c(HS-)+c(H2S) |
13.关于图中各装置的叙述不正确的是( )
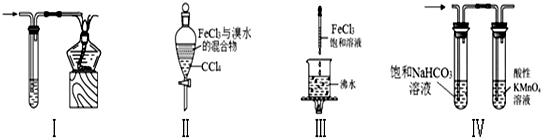

| A. | 装置Ⅰ:可用于处理CO尾气 | |
| B. | 装置Ⅱ:充分振荡后静置,下层溶液为红棕色,上层无色 | |
| C. | 装置Ⅲ:当液体呈红褐色,停止加热,让光束通过体系可产生丁达尔效应 | |
| D. | 装置Ⅳ:可用于除去CO2气体中的HCl和SO2气体 |