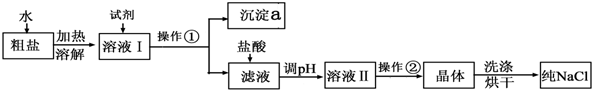
题目内容
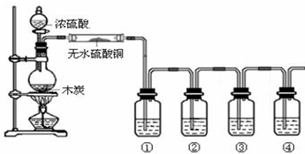
9.为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)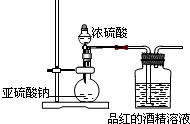
(1)亚硫酸钠与浓硫酸反应的化学方程式:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑;
(2)为探究干燥的SO2 能不能使品红褪色,请指出设计的实验装置图中两个明显的不足:①SO2未干燥,②没有进行尾气处理;
(3)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是SO2直接导致.所以,SO2 通过品红水溶液后,引起品红褪色的微粒可能是H2SO3、HSO3-或SO32-.
分析 (1)亚硫酸钠和浓硫酸之间反应生成硫酸钠、水以及二氧化硫;
(2)根据实验目的及二氧化硫的性质分析,制取干燥的气体且二氧化硫有毒,应有尾气处理装置;
(3)根据二氧化硫和水反应的方程式判断溶液中存在的微粒,注意二氧化硫和水的反应是可逆反应.
解答 解:(1)亚硫酸钠与浓硫酸反应生成硫酸钠、二氧化硫和水,反应的化学方程式:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H20,故答案为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O;
(2)该实验是探究干燥的SO2能不能使品红褪色,所以二氧化硫通入品红溶液前要进行干燥;二氧化硫有毒,所以多余气体不能直接排空,故要有尾气处理装置.
故答案为:①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);②没有尾气吸收装置;
(3)二氧化硫和水反应生成亚硫酸,亚硫酸是二元弱酸,所以能发生两步电离,第一步生成氢离子和亚硫酸氢根离子,亚硫酸氢根离子电离生成亚硫酸根离子和氢离子,SO2+H2O?H2SO3,H2SO3?H++HSO3-,HSO3-?H++SO32-,这些反应都是可逆反应,所以存在的含有硫元素的微粒有(除二氧化硫外)H2SO3、HSO3-、SO3 2-.
点评 本题考查了二氧化硫漂白性的探究实验,难度较大,分析图中各个装置在检验的过程中所发挥的作用,这是解答此类问题首先应明确的关键问题.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
5.将6.4gSO2和8.0gSO3相比较,下列结论中错误的是( )
| A. | 它们所含氧原子数目之比为2:3 | B. | 它们的体积之比为1:1 | ||
| C. | 它们所含原子数目之比为3:4 | D. | 它们的分子数目之比为1:1 |
6.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,则下列叙述中正确的是( )
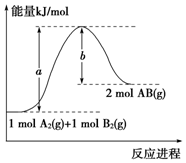

| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应过程的活化能为b kJ•mol-1 | |
| C. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 | |
| D. | 该反应的反应热△H=+(a-b) kJ•mol-1 |
3.下列各组离子能在溶液中大量共存的是( )
| A. | Ag+、K+、NO3-、Cl- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、OH-、Cl- | D. | H+、Na+、CO32-、SO42- |
1.一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)?COCl2(g),其中容器Ⅰ中5min时到达平衡.
下列说法中正确的是( )
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80% |
19.某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,发生反应:A(g)+B(g)?C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表,下列说法正确的是( )
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5 s的平均速率v(A)=0.03 mol•L-1•s-1 | |
| B. | 达到平衡时,B的转化率为80% | |
| C. | 相同温度下,若起始时向容器中充入2.0 mol C,则达到平衡时C的浓度小于0.2 mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆) |