题目内容
1.一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)?COCl2(g),其中容器Ⅰ中5min时到达平衡.| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80% |
分析 A.I中平衡时得到△n(COCl2)=0.8mol,根据方程式知,参加反应的△n(CO)=△n(COCl2)=0.8mol,则5min内v(CO)=$\frac{\frac{△n(CO)}{V}}{△t}$;
B.I、III是等效平衡,升高温度产物浓度降低,说明平衡逆向移动;
C.相同温度下化学平衡常数相等,根据化学平衡常数计算氯气初始物质的量;
D.I中加入1.0molCO、1.0molCl2时,CO转化率=$\frac{0.8mol}{1.0mol}$×100%=80%,如果起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,容器内压强小于加入1.0molCO、1.0molCl2时压强,减小压强平衡向气体体积增大的方向移动.
解答 解:A.I中平衡时得到△n(COCl2)=0.8mol,根据方程式知,参加反应的△n(CO)=△n(COCl2)=0.8mol,则5min内v(CO)=$\frac{\frac{△n(CO)}{V}}{△t}$=$\frac{\frac{0.8mol}{0.5L}}{5min}$=0.32 mol•L-1•min-1,故A错误;
B.I、III是等效平衡,升高温度平衡向吸热方向移动,升高温度产物浓度降低,说明平衡逆向移动,则正反应是放热反应,故B错误;
C.I中达到平衡状态时,n(CO)=n(Cl2)=1.0mol-0.8mol=0.2mol,则平衡时c(CO)=c(Cl2)=$\frac{0.2mol}{0.5L}$=0.4mol/L,c(COCl2)=$\frac{0.8mol}{0.5L}$=1.6mol/L,化学平衡常数K=$\frac{1.6}{0.4×0.4}$=10,
温度相同化学平衡常数相同,所以II中化学平衡常数K=10,
CO(g)+Cl2(g)?COCl2(g),
初始1.0 a 0
反应0.5 0.5 0.5
平衡0.5 (a-0.5)0.5
平衡时c(CO)=c(COCl2)=$\frac{0.5mol}{0.5L}$=1mol/L,c(Cl2)=$\frac{a-0.5}{0.5}$mol/L=2(a-0.5)mol/L,
化学平衡常数K=$\frac{1}{1×2(a-0.5)}$=10,
a=0.55,
故C正确;
D.I中加入1.0molCO、1.0molCl2时,CO转化率=$\frac{0.8mol}{1.0mol}$×100%=80%,如果起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,容器内压强小于加入1.0molCO、1.0molCl2时压强,减小压强平衡向气体体积增大的方向移动,所以CO转化率小于80%,故D正确;
故选CD.
点评 本题考查化学平衡计算及浓度对化学平衡移动影响,为高频考点,侧重考查学生分析计算能力,明确温度与化学平衡常数关系水解本题关键,注意C选项的计算方法,题目难度不大.

 高效智能课时作业系列答案
高效智能课时作业系列答案| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有明显变化 |
| ② | B+D | 有无色、无味气体生成 |
| ③ | B+C | 有白色沉淀生成 |
| ④ | A+D | 有白色沉淀生成 |
(1)A、B、C、D溶液中溶质的化学式:ACaCl2;BHCl;CAgNO3;DNa2CO3.
(2)写出实验顺序中发生反应的②③④中有关的离子方程式:②CO32-+2H+=CO2↑+H2O;③Cl-+Ag+=AgCl↓;④CO32-+Ca2+=CaCO3↓.
| A. | 增大压强,平衡向右移动 | B. | 加入催化剂,Z的产率增大 | ||
| C. | 增大c(X),X的转化率增大 | D. | 降低温度,Y的转化率增大 |
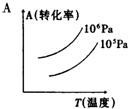 有一化学平衡mA(g)+nB(g)═PC(g)+qD(g),如图表示的转化率与压强、温度的关系.由此得出的正确结论是( )
有一化学平衡mA(g)+nB(g)═PC(g)+qD(g),如图表示的转化率与压强、温度的关系.由此得出的正确结论是( )| A. | 正反应是吸热反应,(m+n)>(p+q) | B. | 正反应是吸热反应,(m+n)<(p+q) | ||
| C. | 正反应是放热反应,(m+n)>(p+q) | D. | 正反应是放热反应,(m+n)<(p+q) |
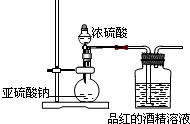
 浓硫酸是一种重要的化工产品.
浓硫酸是一种重要的化工产品.
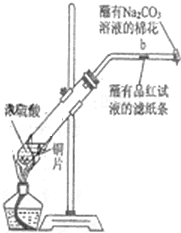 如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:
如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答: