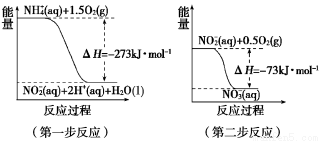
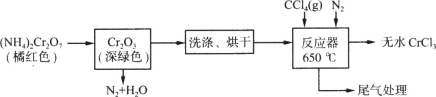
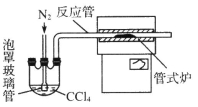
题目内容
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列说法正确的是
A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸
B.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应
C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中含SO42—
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
A
【解析】
试题分析:A、浓硝酸不稳定分解生成的二氧化氮溶于硝酸,使硝酸呈黄色,故A正确;B、氯气氧化碘离子为碘单质,碘遇淀粉变蓝色,故B错误;C、溶液含有Ag+或SO42-或SO32-,加入硝酸酸化的氯化钡溶液,会有白色沉淀生成,不能说明溶液含SO42-,故C错误;D、钝化是生成一层致密的氧化物保护膜,阻止内部金属继续反应,铜片与浓硫酸反应需要加热,不加热铜与浓硫酸不反应,不能说明铜在冷的浓硫酸中发生钝化,故D错误,故选:A。
考点:考查元素及其化合物性质的判断

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【化学——选修3:物质结构与性质】(15分)
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为 ,CO有多种等电子体,其中常见的一种分子是 。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有 个δ键,C原子的杂化方式为 。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是 ,形成的化学键是 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
写出A原子的电子排布图 ,Al原子的第一电离能 (填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是 。
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为 。