题目内容
(20分)三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制备三氯化铬的流程如下图所示:
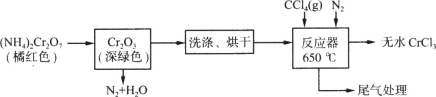
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净? 。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是 。
(3)用下图装置制备CrCl3时,
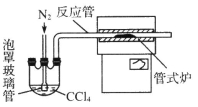
反应管中发生的主要反应为: Cr2O3+3CCl4==2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为:
① ;
② 。
(4)样品中三氯化铬质量分数的测定:称取样品0.3000g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1g Na2O2,充分加热煮沸,适当稀释,然后加入过量2mol·L–1H2SO4至溶液呈强酸性,此时铬以Cr2O72–存在,再加入1.1g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5min后,加入1mL指示剂,用0.0250mol·L–1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL。(已知:2Na2S2O3+I2 == Na2S4O6+2NaI)
①滴定实验可选用的指示剂名称为 ,判定终点的现象是 ;若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果 (填“偏高”“偏低”或“无影响”)。
②加入Na2O2后要加热煮沸,其主要原因是 。
③加入KI时发生反应的离子方程式为 。
④样品中无水三氯化铬的质量分数为 。(结果保留一位小数)
20.(20分)(1)最后一次的洗涤液呈无色(2)水浴加热(并用温度计指示温度)
①赶尽反应装置中的氧气;②鼓气使反应物进入管式炉中进行反应
(4)①淀粉(2分);最后一滴滴入时,蓝色恰好完全褪去,且半分钟内不恢复原色 ; 偏低
②除去其中溶解的氧气,防止氧气将I—氧化,产生误差
③Cr2O72—+6I—+14H+== 2Cr3+ +3I2+7H2O ④ 92.5%
【解析】
试题分析:(1)重铬酸铵分解不完全,还可能含有其它可溶性杂质,用蒸馏水洗涤除去其中可溶性杂质;因为(NH4)2Cr2O7显桔红色,最后一次洗涤的流出液呈无色,说明洗涤干净.判断其已洗涤干净的方法是最后一次的洗涤液呈无色;
(2)因为CCl4沸点为76.8℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量,并用温度计指示温度.;
(3)则向三颈烧瓶中通入N2的作用为①赶尽反应装置中的氧气; ②鼓气使反应物进入管式炉中进行反应 ;(4)①利用Na2S2O3滴定生成I2,I2遇淀粉显蓝色,可以用淀粉作指示剂,I2反应完毕蓝色褪去,答案为:淀粉;判定终点的现象是最后一滴滴入时,蓝色恰好完全褪去,且半分钟内不恢复原色 ;若滴定时振荡不充分,刚看到局部变色就停止滴定,加入的液体减少,会使样品中无水三氯化铬的质量分数的测量结果偏低;②溶液中有溶解的氧气,氧气可以氧化I-氧化,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差,故加热煮沸,其主要原因是:除去其中溶解的氧气,防止氧气将I-氧化,产生误差;③加入KI时发生反应的离子方程式为Cr2O72—+6I—+14H+== 2Cr3+ +3I2+7H2O
④令25.00mL溶液中n(Cr3+),由Cr元素守恒及方程式可得关系式2Cr3++~Cr2O72-~3I2~6Na2S2O3,根据关系式计算.2Cr3++~Cr2O72-~3I2~6Na2S2O3,
2 6
n(Cr3+) 0.0250mol/L×0.021L n(Cr3+)=0.0250mol/L×0.021L×1/3
所以250mL溶液中n′(Cr3+)=0.0250mol/L×0.021L×1/3×250/25=0.00175mol,根据Cr元素守恒可知n(CrCl3)=n′(Cr3+)=0.00175mol,所以样品中m(CrCl3)=0.00175mol×158.5g/mol=0.2774g,故样品中无水三氯化铬的质量分数为0.2774/0.3×100%=92.5%.
考点:考查学生对实验方案原理的理解与评价、物质组成含量的测定、滴定应用、化学计算等。

氢气是一种清洁的可再生能源。上海最新研发的“超越”3号氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约为
| A.250mol | B.500mol | C.8kg | D.16kg |
关于“物质的量”叙述正确的是
| A.单位:g.mol-1 |
| B.七个基本物理量之一 |
| C.用来描述微观粒子的质量 |
| D.数值是:6.02×1023 |