题目内容
(6分)
(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3—。两步反应的能量变化示意图如下:
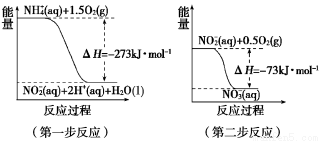
1 mol NH4+ (aq) 全部氧化成NO3—(aq)的热化学方程式是_______________。
(2)、电解NO制备 NH4NO3,其工作原理如图所示,

写出该电解池的电极反应式
阳极: __________________________ 阴极:________________________________
(1)NH4+ (aq)+2O2(g)===2H+(aq)+NO3—(aq)+H2O(l) ΔH=-346 kJ·mol-1 (2分)
(2) 阳极:NO-3e-+2H2O=== NO3—+4H+ (2分)
阴极:NO+5e-+ 6H+=== NH4++ H2O (2分)
【解析】
试题分析:由盖斯定律可知1 mol NH4+ (aq) 全部氧化成NO3—(aq)的反应热为ΔH=—273 kJ·mol-1+(—73 kJ·mol-1)=—346 kJ·mol-1,则其热化学方程式为NH4+ (aq)+2O2(g)===2H+(aq)+NO3—(aq)+H2O(l) ΔH=-346 kJ·mol-1;电解NO制备 NH4NO3,根据工作原理图可知阴极为NO放电,产物为NH4+,阳极为NO放电,产物为NO3—,故其阴极电极反应为NO+5e-+ 6H+=== NH4++ H2O,阳极电极反应为NO-3e-+2H2O=== NO3—+4H+。
考点:盖斯定律与电化学原理

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案氢气是一种清洁的可再生能源。上海最新研发的“超越”3号氢燃料电池轿车,每行驶100km仅耗氢气1kg左右,同时消耗氧气约为
| A.250mol | B.500mol | C.8kg | D.16kg |
 2NO+O2,下列能作为反应达到平衡状态标志的是
2NO+O2,下列能作为反应达到平衡状态标志的是 B.
B.
 <
<