题目内容
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等.下列判断错误的是( )| A、四种元素最高价氧化物对应的水化物均能与NaOH溶液反应 |
| B、气态氢化物的稳定性:Y<W |
| C、原子半径:Y>Z |
| D、含X的盐溶液一定显酸性 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由短周期元素X、Y、Z、W在元素周期表中的位置,可确定X、Y、W为第三周期的元素,Z为第二周期元素,X所处的周期序数与族序数相等,则X为Al元素,故Y为Si元素,W为S元素,Z为N元素,据此结合元素周期律及元素化合物性质解答.
解答:
解:由短周期元素X、Y、Z、W在元素周期表中的位置,可确定X、Y、W为第三周期的元素,Z为第二周期元素,X所处的周期序数与族序数相等,则X为Al元素,故Y为Si元素,W为S元素,Z为N元素,
A.氢氧化铝是两性氢氧化物,能与氢氧化钠反应,硅酸、硝酸、硫酸都能与氢氧化钠发生中和反应,故A正确;
B.非金属性Si<S,故最简单气态氢化物的热稳定性为SiH4<H2S,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Y>Z,故C正确;
D.X为铝元素,铝元素可能存在阴离子中,如偏铝酸根离子,则对应的盐溶液如偏铝酸钠为碱性溶液,故D错误.
故选D.
A.氢氧化铝是两性氢氧化物,能与氢氧化钠反应,硅酸、硝酸、硫酸都能与氢氧化钠发生中和反应,故A正确;
B.非金属性Si<S,故最简单气态氢化物的热稳定性为SiH4<H2S,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Y>Z,故C正确;
D.X为铝元素,铝元素可能存在阴离子中,如偏铝酸根离子,则对应的盐溶液如偏铝酸钠为碱性溶液,故D错误.
故选D.
点评:本题考查结构性质位置关系应用,为高考常见题型,难度中等,侧重于学生的分析能力的考查,注意把握原子结构与元素周期律的递变规律.

练习册系列答案
相关题目
化学与科技、社会、生产、生活等关系密切,下列有关说法不正确的是( )
| A、乙烯的产量是衡量一个国家石油发展水平的标志 |
| B、减少燃煤的使用可以减少有毒有害气体对环境的污染 |
| C、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| D、35%--60%甲醛溶液俗称为福尔马林,具有很好的防腐杀菌效果,可用来浸泡海产品来起到保鲜效果 |
A、B、C、D、E五种元素具有相同的电子层数,A、B的最高价氧化物的水化物水溶液呈酸性,且酸性B>A;C、D的最高价氧化物的水化物的水溶液呈碱性,且碱性C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由大到小的顺序是( )
| A、CDEAB |
| B、ECDAB |
| C、BAEDC |
| D、BADCE |
下列离子方程式书写正确的是( )
| A、Cu(OH)2中加入硫酸:OH-+H+═H2O |
| B、钠加入水中:Na+2H2O═Na++2OH-+H2↑ |
| C、FeSO4溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
| D、Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
 如图是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元素符号.已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒.下列推测不正确的是( )
如图是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元素符号.已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒.下列推测不正确的是( )| A、原子半径X>Y |
| B、最高价氧化物对应的水化物酸性X>Y |
| C、X的氢化物具有强还原性 |
| D、Y与碘同周期,Y最高价氧化物对应的水化物酸性比高碘酸(HIO4)强 |
下列离子方程式书写正确的是( )
| A、Cl2通入Na2SO3溶液:2Cl2+H2O+SO32-═2HClO+SO2↑+2Cl- |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
C、水杨酸(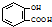 )中加入Na2CO3溶液: )中加入Na2CO3溶液: +CO32-→ +CO32-→ +CO2↑+H2O +CO2↑+H2O |
| D、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+ |



