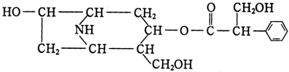
题目内容
写出下列物质的电子式:
①H2O ; ②MgCl2 ;
③N2 ; ④CO2 .
①H2O
③N2
考点:电子式
专题:化学用语专题
分析:①水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键;
②氯化镁为离子化合物,必须标出阴阳离子的电子式;
③氮气中存在3对共用电子对,氮原子最外层达到8个电子;
④二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子.
②氯化镁为离子化合物,必须标出阴阳离子的电子式;
③氮气中存在3对共用电子对,氮原子最外层达到8个电子;
④二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子.
解答:
解:①水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,
,
故答案为: ;
;
②氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: ,
,
故答案为: ;
;
③氮气中存在氮氮三键,氮气的电子式为 ,
,
故答案为: ;
;
④二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,
,
故答案为: .
.
 ,
,故答案为:
 ;
;②氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为:
 ,
,故答案为:
 ;
;③氮气中存在氮氮三键,氮气的电子式为
 ,
,故答案为:
 ;
;④二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
 ,
,故答案为:
 .
.
点评:本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列说法中正确的是( )
| A、常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C、常温下,c(NH4+)相等的①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| D、当溶液中存在的离子只有Cl-、OH-、NH4+、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等.下列判断错误的是( )| A、四种元素最高价氧化物对应的水化物均能与NaOH溶液反应 |
| B、气态氢化物的稳定性:Y<W |
| C、原子半径:Y>Z |
| D、含X的盐溶液一定显酸性 |
设NA为阿伏伽德罗常数的数值,下列说法中正确的是( )
| A、在常温常压下,11.2L氯气中含有的分子数为NA |
| B、2L 0.5mol?L-1 Na2SO4溶液中含有的Na+数为NA |
| C、在常温常压下,1mol NH3含有的原子数为4NA |
| D、2g H2中含有的电子数为NA |