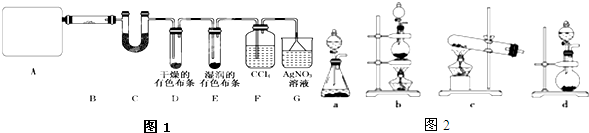
题目内容
12.含有NaOH的Cu(OH)2悬浊液可用于检验醛基,其反应如下:2CH3CHO+2Cu(OH)42- $\stackrel{△}{→}$2CH3COO-+Cu2O↓+5H2O(1)Cu2+基态核外电子排布式为[Ar]3d9.
(2)乙醛中碳原子的轨道杂化类型是sp2,sp3;1mol乙酸分子中含有σ键的数目为7mol.
(3)与H2O互为等电子体的一种阴离子为NH2-(填化学式).H2O与CH3CHO能够互溶,除了它们都是极性分子外,还因为分子间形成氢键.
(4)画出配离子Cu(OH)42-的结构式
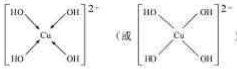 (不考虑空间构型).
(不考虑空间构型).
分析 (1)根据电子排布式的书写方法,Cu2+基态核外电子排布式为[Ar]3d9;
(2)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;单键都为σ键,双键中有1个σ键;
(3)H2O有3个原子8个价电子,根据等电子体原理可知,与水互为等电子体的阴离子为NH2-;为分子间形成氢键促进溶解;
(4)配离子Cu(OH)42-的结构式 .
.
解答 解:(1)根据电子排布式的书写方法,Cu2+基态核外电子排布式为[Ar]3d9,故答案为[Ar]3d9;
(2)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;1个乙酸分子含有7molσ键,故答案为:sp2,sp3;7mol;
(3)H2O有3个原子8个价电子,根据等电子体原理可知,与水互为等电子体的阴离子为NH2-;H2O与CH3CHO能够互溶,除了它们都是极性分子外,还因为分子间形成氢键,故答案为:NH2-;分子间形成氢键;
(4)配离子Cu(OH)42-的结构式 ,故答案为:
,故答案为: .
.
点评 本题考查了核外电子排布式、结构式、杂化轨道类型、等电子体等基本化学术语,要求学生有扎实的基本知识,为中等难度的试题,但容易失分.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.已知X、Y是主族元素,I为电离能,单位是kJ/mol.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氧形成化合物时,化学式可能是X2O或X2O2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
1.纽扣式Li-MnO2电池是使用较广的锂电池,电极材料是锂和石墨,电解质溶液是LiClO4溶于碳酸丙烯(PC)和1,2-二甲基氧基乙烷(DME)得到的混合溶剂.电池总反应为Li+MnO2═LiMnO2下列有关说法不正确的是( )
| A. | 电池工作室,锂电极反应式为Li-e-═Li+ | |
| B. | 若将石墨换成铁时,电池还能继续工作 | |
| C. | 电池工作时,电解质中的ClO4-运动到电池的石墨极 | |
| D. | 正极发生了还原反应 |
2.第33号元素基态原子核电子占有的原子轨道数是( )
| A. | 16 | B. | 17 | C. | 18 | D. | 19 |
 Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.
Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.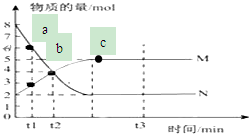 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: