��Ŀ����
17��Ϊ̽����ʵ�����Ʊ�Cl2�Ĺ�������ˮ������HCl�ӷ�������ͬʱ֤��������ijЩ���ʣ���ͬѧ�������ͼ1��ʾ��ʵ��װ�ã�֧���õ�����̨ʡ�ԣ�����Ҫ��ش�����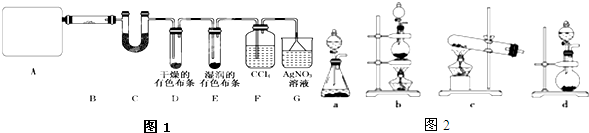
��1����ʵ���У�A���ֵ�װ����b����ͼ2����ĸ��ţ���д��A�з��������ӻ�ѧ����ʽMnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$ Mn2++Cl2��+2H2O��
��2����װ��B��ʢ�ŵ��Լ�����Ϊ��ˮ����ͭ��������֤����ˮ��������
��װ��D��E�г��ֵIJ�ͬ����˵����������Ư���ԣ���������Ư����
��װ��F����������������
��д��װ��G�з�����Ӧ�����ӷ���ʽAg++Cl-=AgCl��
��3����ͬѧ��Ϊ��ͬѧ��ʵ����ȱ�ݣ�����ȷ������ͨ��AgNO3��Һ�е�����ֻ��һ�֣�Ϊ��ȷ��ʵ����۵Ŀɿ��ԣ�֤������ͨ��AgNO3��Һ������ֻ��һ�֣���ͬѧ�����ij����װ��֮���ټ�һ��װ�ã�����Ϊ��װ��Ӧ����F��G֮�䣨��װ����ĸ��ţ���װ����Ӧ����ʪ��ĵ���KI��ֽ����ʪ�����ɫ�������Լ�����д�Լ�����Ʒ���ƣ���
���� ʵ������Ũ������������̼��ȷ�Ӧ��ȡ������̽����ʵ�����Ʊ�Cl2�Ĺ�������ˮ������HCl�ӷ������������������ʣ����ݷ�Ӧ��״̬�ͷ�Ӧ����ȷ������װ�ã�������ˮ����ͭ����ˮ�Ĵ��ڣ�����������Ư���ԣ�����ͨ��������ɫ������ʪ����ɫ������֤����Ư���Ե�Ϊ�����ᣬ����������Ϊ�����Ȼ���Ĵ��ڣ�ѡ����������Һ��Ϊ�ų������ĸ���Ӧ�����Ȼ�̼������������ʪ����۵⻯����Һȷ�������Ƿ�������ȫ��������ɫ��������֤���Ȼ�����ڣ�
��1����ʵ���У�A����Ϊ��ȡ����װ�ã�ʵ�����ö���������Ũ��������Ʊ���������Ӧ�����Ȼ��̡�������ˮ�����ݷ�Ӧ����ѡ��ʵ��װ�ã�
��2����ʵ���ҳ�����ˮ����ͭ����ˮ�Ĵ��ڣ���װ��D��E�г��ֵIJ�ͬ����˵����������Ư���ԣ���������Ư���ԣ���Ϊ�ų������ĸ���Ӧ�����Ȼ�̼�����������������Ӻ������ӷ�Ӧ�����Ȼ�����
��3��Gװ����������HCl���壬Ϊ��ȷ��ʵ����۵Ŀɿ��ԣ�Ӧ�ų������ĸ��ţ�
��� �⣺��1������ʵ���Ŀ�ģ�����ȡ��������ʵ���У�A����Ϊ��ȡ����װ�ã�ʵ�����ö���������Ũ��������Ʊ�������Ϊ�����Һ���������ȡ�����װ�ã�Ӧѡ��װ��b
������������Ũ���ᷴӦ�����Ȼ��̡�������ˮ����ѧ����ʽ��MnO2+4HCl$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O�����ӷ���ʽΪ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$ Mn2++Cl2��+2H2O��
�ʴ�Ϊ��b��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$ Mn2++Cl2��+2H2O��
��2����װ��A��ȡ�������Ʊ�Cl2�Ĺ�������ˮ�����ӷ�������Ϊ��֤��ˮ�����Ĵ��ڣ�����ˮ����ͭ��ˮ��Ӧ������ɫ��ˮ������ͭ����������ˮ��
�ʴ�Ϊ����ˮ����ͭ��֤����ˮ����������
�ڸ��������û��Ư���ԣ�D����ɫ��������ɫ��������ˮ��Ӧ���ɵ�HClO����Ư���ԣ�E��ʪ�����ɫ������ɫ��˵������û��Ư���ԣ���ˮ��Ư���ԣ�
�ʴ�Ϊ��������Ư���ԣ���������Ư���ԣ�
������ͨ����������ҺҲ������AgCl������װ��F�����ã���ȥ��������ֹ��HCl�������ĸ��ţ�
�ʴ�Ϊ������������
��װ��G�������Ӻ������ӷ�Ӧ�����Ȼ��������ӷ���ʽΪ��Ag++Cl-=AgCl����
�ʴ�Ϊ��Ag++Cl-=AgCl����
��3��Gװ����������HCl���壬Ϊ��ȷ��ʵ����۵Ŀɿ��ԣ�Ӧ�ų������ĸ��ţ���F��������֮��Ҫ���������Ƿ���ȫ��ȥ��������������ǿ�����Ե����ʣ�����ʪ��ĵ���KI��ֽ���飨��ʪ�����ɫ���������粻��ɫ��˵���Ѿ���ȫ��ȥ��
�ʴ�Ϊ��F��G��ʪ��ĵ���KI��ֽ����ʪ�����ɫ��������
���� ���⿼����������ȡԭ����ʵ��װ�����������⡢���������ʡ������Ӽ���ȣ��ؼ������ʵ���Ŀ����ԭ��ʵ�����Ʊ�������ʵ��������������ʵ�ʵ����֤������ƺͷ����жϣ���Ӧ�����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д� �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�| A�� | ϡ�������ͭƬ�ϣ�Cu+2H+=Cu2++H2�� | |
| B�� | SO2ͨ��BaCl2��Һ�У�Ba2++SO2+H2O=BaSO3��+2H+ | |
| C�� | �������Һ��Ba��OH��2��Һ��Ӧ��Ba2++SO42-=BaSO4�� | |
| D�� | FeCl2��Һ��Cl2��Ӧ��2Fe2++Cl2=2Fe3++2Cl- |
| ���� | HCOOH | HClO | H2CO3 | H2SO3 |
| ���볣�� ��25�棩 | Ki=1.77��10-4 | Kii=2.98��10-6 | K1Ki1=4.3��10-7 Ki2=5.6��10-11 | Ki1=1.54��10-2 Ki2=5.6��10-7 |
��2��1molCl2��2molNa2CO3��aq����Ӧ������NaCl���NaHCO3��NaClO���ѧʽ����
��3����һ������NaHCO3��aq����ͨ��������SO2��g������Ӧ�����ӷ���ʽΪHCO3-+SO2��HSO3-+CO2����
�����ᣨH2SeO3��Ҳ��һ�ֶ�Ԫ���ᣬ��������һ����ɫ���壬������ˮ���н�ǿ�������ԣ�
��4�����������������ع��ȿ��Ƶ����ᣨH2SeO4������ƽ�÷�Ӧ����ʽ�����������ת��
�ķ������Ŀ��
5H2SeO3+2KMnO4��1K2SeO4+2MnSeO4+2H2SeO4+3H2O
��5������ͬ���Ԫ��Te������������ˮ�������ᣨH6TeO6�������Ա�H2SO4����ѡ�ǿ�������������������Ա�����ǿ����������ͨ��SO2���壬����Ӧ�����ɵ�TeO2��Te�����ʵ���֮��Ϊ2��1��д���÷�Ӧ�Ļ�ѧ����ʽ5SO2+3H6TeO6��2TeO2+Te+5H2SO4+4H2O����6mol������һ����SO2ǡ����ȫ��Ӧ��������Һ���Ϊ20L����������Һ��pHΪ0��
| A�� | ��һ�����ܣ�B��Be��Li | |
| B�� | �縺�ԣ�F��N��O | |
| C�� | Fe2+�����������Ų�ʽΪ��3s23p63d6 | |
| D�� | ��̬ͭԭ�ӵļ۵����Ų�ͼ�� |
| A�� | C23H48��C25H52��C27H56��̼�������μ�С | |
| B�� | 1molC23H48�����ۼ�70mol | |
| C�� | C23H48��C25H52��C27H56��Ϊͬϵ�� | |
| D�� | C23H48��C25H52��C27H56��������ˮ |
 �ҹ�֧�֡����İ��ˡ���һ����Ҫ�����Ǽ�������˶�Ա�����˷ܼ���ij���˷ܼ��Ľṹ��ʽ��ͼ��ʾ���йظ����ʵ�˵����ȷ���ǣ�������
�ҹ�֧�֡����İ��ˡ���һ����Ҫ�����Ǽ�������˶�Ա�����˷ܼ���ij���˷ܼ��Ľṹ��ʽ��ͼ��ʾ���йظ����ʵ�˵����ȷ���ǣ�������| A�� | ���������ڷ����廯���� | |
| B�� | ���л���ķ���ʽΪC15H18O3 | |
| C�� | ��FeCl3��Һ����ɫ����Ϊ�������뱽������ͬϵ�� | |
| D�� | 1mol�û����������뺬3molBr2����ˮ������Ӧ |
| A�� | K��F | B�� | Na��Cl | C�� | Al��S | D�� | Mg��Cl |

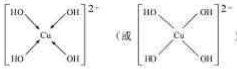 �������ǿռ乹�ͣ���
�������ǿռ乹�ͣ���