题目内容
下列描述不符合生产、生活实际的是( )
| A、家用炒锅残留盐溶液时易发生吸氧腐蚀 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、电解水制氢气时,用铜作阳极 |
| D、在镀件上电镀锌,用锌作阳极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.在中性或弱酸性环境中,铁易发生吸氧腐蚀;
B.精炼铜时,纯铜为阴极;
C.电解水时,应用惰性电极作阳极;
D.电镀时,镀层金属为阳极.
B.精炼铜时,纯铜为阴极;
C.电解水时,应用惰性电极作阳极;
D.电镀时,镀层金属为阳极.
解答:
解:A.在中性或弱酸性环境中,铁易发生吸氧腐蚀,故A正确;
B.电解法精炼粗铜,阴极发生还原反应,铜离子得到电子生成铜,所以用纯铜作阴极,故B正确;
C.电解水时,应用惰性电极作阳极,如用铜作阳极,则阳极铜被氧化生成氢氧化铜,不利于电解,故C错误;
D.在镀件上电镀锌,阳极发生氧化反应,必须是镀层金属为阳极,金属镀件作阴极,故D正确.
故选C.
B.电解法精炼粗铜,阴极发生还原反应,铜离子得到电子生成铜,所以用纯铜作阴极,故B正确;
C.电解水时,应用惰性电极作阳极,如用铜作阳极,则阳极铜被氧化生成氢氧化铜,不利于电解,故C错误;
D.在镀件上电镀锌,阳极发生氧化反应,必须是镀层金属为阳极,金属镀件作阴极,故D正确.
故选C.
点评:本题考查电解原理知识,侧重于电化学的综合应用,注意把握电解池的工作原理和电极反应,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、1molCu与足量的S反应转移电子数为2NA |
| B、1mol 1H含有的中子数为NA |
| C、常温常压下,1 mol氦气含有的核外电子数为2NA |
| D、标准状况下,2.24LH2O的质量是1.8g |
下列过程需加入还原剂才能实现的是( )
| A、KMnO4→MnO2 |
| B、HSO3-→SO2 |
| C、Cu2+→Cu |
| D、I-→I2 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,17g羟基中含有的电子数目为10NA |
| B、常温常压下,28g由C2H4和C3H6组成的混合气体中含有的碳原子数目为2NA |
| C、0.05mol熔融的NaHSO4中含有的离子数目为0.15NA |
| D、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
下列叙述正确的是( )
| A、溶液和胶体的本质区别是有无丁达尔效应 |
| B、明矾在水中能形成Al(OH)3胶体,可作净水剂 |
| C、玻璃、水泥和光导纤维的主要成分都是硅酸盐 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色,将SO2通入溴水,溴水褪色后加热也恢复原色 |
 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如图所示实验.下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如图所示实验.下列有关说法不正确的是( )| A、阳极反应:Ag-e-═Ag+ |
| B、阴极质量不断增大 |
| C、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| D、若α-AgI是Ag+导电,则通电一段时间后晶体质量减小 |
 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题: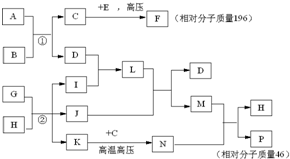 已知C、I、J是常见的气体,A、D是常见的固态非金属单质,E为常见金属,B可用于生产光导纤维,G、H是海水中的主要物质,N是一种盐.在核磁共振氢谱中P有两种峰,F燃烧产生红棕色烟,1molF在真空中完全分解剩余固体的质量是原来的28.6%.试回答下列问题
已知C、I、J是常见的气体,A、D是常见的固态非金属单质,E为常见金属,B可用于生产光导纤维,G、H是海水中的主要物质,N是一种盐.在核磁共振氢谱中P有两种峰,F燃烧产生红棕色烟,1molF在真空中完全分解剩余固体的质量是原来的28.6%.试回答下列问题