题目内容
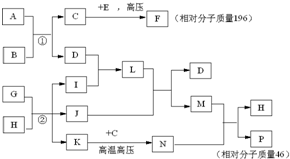 已知C、I、J是常见的气体,A、D是常见的固态非金属单质,E为常见金属,B可用于生产光导纤维,G、H是海水中的主要物质,N是一种盐.在核磁共振氢谱中P有两种峰,F燃烧产生红棕色烟,1molF在真空中完全分解剩余固体的质量是原来的28.6%.试回答下列问题
已知C、I、J是常见的气体,A、D是常见的固态非金属单质,E为常见金属,B可用于生产光导纤维,G、H是海水中的主要物质,N是一种盐.在核磁共振氢谱中P有两种峰,F燃烧产生红棕色烟,1molF在真空中完全分解剩余固体的质量是原来的28.6%.试回答下列问题(1)写出化学式或结构式:F
(2)反应①的化学方程式为:
(3)反应②的离子方程式为:
考点:无机物的推断
专题:推断题
分析:B可用于生产光导纤维,应为SiO2,A、D是常见的固态非金属单质,则A与B的反应为置换反应,A应为C单质,则D为Si,C为CO,E为常见金属,F燃烧产生红棕色烟,可知E为Fe,又1molF在真空中完全分解剩余固体的质量是原来的28.6%,设F的化学式为Fe(CO)x,则
×100%=28.6%,x=5,F为Fe(CO)5,G、H是海水中的主要物质,可为NaCl和H2O,则反应②应为电解食盐水的反应,生成氢气、氯气和氢氧化钠,其中I能与Si反应,则I为Cl2,J为H2,K为NaOH,由转化关系可知M为HCl,在核磁共振氢谱中P有两种峰,且相对分子质量为46,应为HCOOH,则N为HCOONa,H为NaCl,所以G为H2O,以此解答该题.
| 56 |
| 56+28x |
解答:
解:B可用于生产光导纤维,应为SiO2,A、D是常见的固态非金属单质,则A与B的反应为置换反应,A应为C单质,则D为Si,C为CO,E为常见金属,F燃烧产生红棕色烟,可知E为Fe,又1molF在真空中完全分解剩余固体的质量是原来的28.6%,设F的化学式为Fe(CO)x,则
×100%=28.6%,x=5,F为Fe(CO)5,G、H是海水中的主要物质,可为NaCl和H2O,则反应②应为电解食盐水的反应,生成氢气、氯气和氢氧化钠,其中I能与Si反应,则I为Cl2,J为H2,K为NaOH,由转化关系可知M为HCl,在核磁共振氢谱中P有两种峰,且相对分子质量为46,应为HCOOH,则N为HCOONa,H为NaCl,所以G为H2O,
(1)由以上分析可知,F为Fe(CO)5,P为HCOOH,故答案为:Fe(CO)5;HCOOH;
(2)反应①为二氧化硅与一氧化碳在高温下的反应,反应的方程式为SiO2+2C
Si+2CO↑,故答案为:SiO2+2C
Si+2CO↑;
(3)反应②为电解饱和食盐水的反应,反应的离子方程式为2Cl-+2H2O═H2↑+Cl2↑+2OH-,故答案为:2Cl-+2H2O═H2↑+Cl2↑+2OH-.
| 56 |
| 56+28x |
(1)由以上分析可知,F为Fe(CO)5,P为HCOOH,故答案为:Fe(CO)5;HCOOH;
(2)反应①为二氧化硅与一氧化碳在高温下的反应,反应的方程式为SiO2+2C
| ||
| ||
(3)反应②为电解饱和食盐水的反应,反应的离子方程式为2Cl-+2H2O═H2↑+Cl2↑+2OH-,故答案为:2Cl-+2H2O═H2↑+Cl2↑+2OH-.
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握题目的突破口,难度中等.

练习册系列答案
相关题目
下列有关金属及其化合物的说法中,错误的是( )
| A、生活中用碱液洗涤铝制饮具 |
| B、用小苏打治疗胃酸过多 |
| C、用漂白粉做公共泳池的消毒剂 |
| D、铁、铜制品应要保持干燥,以防生锈 |
下列描述不符合生产、生活实际的是( )
| A、家用炒锅残留盐溶液时易发生吸氧腐蚀 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、电解水制氢气时,用铜作阳极 |
| D、在镀件上电镀锌,用锌作阳极 |
下列实验操作不正确的是( )
| A、用浓硫酸配制一定浓度的稀硫酸时,用量筒量取浓硫酸倒入盛水的烧杯中稀释,且用水洗涤量筒,洗涤液一并注入烧杯 |
| B、除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法 |
| C、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| D、NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |

 某石蕊的分子结构如图所示.
某石蕊的分子结构如图所示.