题目内容
(1)①现有11g由
H和
O组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个.②请画出O2-微粒的结构示意图: .
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为 ,分子物质的量之比为 ,所含氧原子个数之比为 .
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42-离子浓度之比为 ,SO42-离子数目之比为 .
(4)20.6g NaR含有Na+0.2mol,则NaR的摩尔质量为 ,则含R 8.0g的NaR的物质的量为 mol.
(5)实验室用二氧化锰与浓盐酸反应制取氯气,反应方程式如下:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
若0.1molMnO2与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl2在标准状况下的体积为 L.
2 1 |
18 8 |
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42-离子浓度之比为
(4)20.6g NaR含有Na+0.2mol,则NaR的摩尔质量为
(5)实验室用二氧化锰与浓盐酸反应制取氯气,反应方程式如下:MnO2+4HCl(浓)
| ||
若0.1molMnO2与足量的浓盐酸充分反应,则有
考点:物质的量的相关计算,化学方程式的有关计算,物质的量浓度的相关计算
专题:计算题
分析:(1)①根据n=
计算水的物质的量,结合分子含有含有中子数、电子数计算中子、电子的物质的量,再根据N=nNA计算电子数目;
②O2-离子质子数为8,核外电子数为10,有2个电子层,各层电子数为2、8;
(2)令SO2和SO3的质量都为1g,根据n=
计算它们的物质的量,根据m=nM计算硫元素质量之比,分子数目之比等于物质的量之比,结合分子中含有O原子数目确定所含氧原子个数之比;
(3)溶液中c(SO42-)=3c[Al2(SO4)3],据此判断SO42-离子浓度之比;根据n=cV确定SO42-离子数目之比.
(4)根据M=
计算NaR的摩尔质量;进而计算R的摩尔质量,根据n=
计算n(R),结合化学式确定n(NaR);
(5)被氧化的HCl生成氯气,根据方程式计算氯气的物质的量,根据氯原子守恒计算被氧化的HCl;结合Cl元素化合价变化计算转移电子;根据V=nVm计算氯气的体积.
| m |
| M |
②O2-离子质子数为8,核外电子数为10,有2个电子层,各层电子数为2、8;
(2)令SO2和SO3的质量都为1g,根据n=
| m |
| M |
(3)溶液中c(SO42-)=3c[Al2(SO4)3],据此判断SO42-离子浓度之比;根据n=cV确定SO42-离子数目之比.
(4)根据M=
| m |
| n |
| m |
| M |
(5)被氧化的HCl生成氯气,根据方程式计算氯气的物质的量,根据氯原子守恒计算被氧化的HCl;结合Cl元素化合价变化计算转移电子;根据V=nVm计算氯气的体积.
解答:
解:(1)①11g由21H和188O组成的水分子的物质的量=
=0.5mol,21H2188O分子中含有中子数=18-8+2=12,故含有中子的物质的量=0.5mol×12=6mol,21H2188O分子中含有质子数=8+2=10,故含有质子的物质的量=0.5mol×10=5mol,故含有电子数目为5mol×NAmol-1=5NA,
故答案为:0.5;6;5NA;
②O2-离子质子数为8,核外电子数为10,有2个电子层,各层电子数为2、8,其结构示意图为: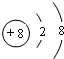 ,
,
故答案为: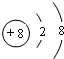 ;
;
(2)令SO2和SO3的质量都为1g,SO2的物质的量=
=
mol,SO3的物质的量=
=
mol,
二者含有硫元素质量之比=
mol×32g/mol:
mol×32g/mol=5:4
分子数目之比等于物质的量之比=
mol:
mol=5:4
所含氧原子个数之比═
mol×2:
mol×3=5:6
故答案为:5:4;5:4;5:6;
(3)两Al2(SO4)3溶液的浓度相等,溶液中c(SO42-)=3c[Al2(SO4)3],故两溶液中SO42-离子浓度相等,所含SO42-离子浓度之比=1:1;
SO42-离子浓度相等,根据n=cV可知,SO42-离子数目之比=物质的量之比=体积之比=0.2L:0.5L=2:5,
故答案为:1:1;2:5;
(4)20.6g NaR含有Na+0.2mol,NaR的物质的量为0.2mol,NaR的摩尔质量为
=103g/mol,故R的摩尔质量=103g/mol-23g/mol=80g/mol,8gR元素物质的量=
=0.1mol,故含R 8.0g的NaR的物质的量为0.1mol,
故答案为:103g/mol;0.1;
(5)由方程式MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑,可知0.1molMnO2与足量的浓盐酸充分反应,生成氯气的物质的量=0.1mol,被氧化的HCl生成氯气,根据氯原子守恒可知,被氧化的HCl=0.1mol×2=0.2mol;反应中Cl元素化合价由-价升高为0价,故转移电子为0.2mol×1=0.2mol,标况下,生成氯气的体积=0.1mol×22.4L/mol=2.24L,
故答案为:0.2;0.2;2.24.
| 11g |
| 22g/mol |
故答案为:0.5;6;5NA;
②O2-离子质子数为8,核外电子数为10,有2个电子层,各层电子数为2、8,其结构示意图为:
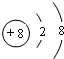 ,
,故答案为:
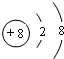 ;
;(2)令SO2和SO3的质量都为1g,SO2的物质的量=
| 1g |
| 64g/mol |
| 1 |
| 64 |
| 1g |
| 80g/mol |
| 1 |
| 80 |
二者含有硫元素质量之比=
| 1 |
| 64 |
| 1 |
| 80 |
分子数目之比等于物质的量之比=
| 1 |
| 64 |
| 1 |
| 80 |
所含氧原子个数之比═
| 1 |
| 64 |
| 1 |
| 80 |
故答案为:5:4;5:4;5:6;
(3)两Al2(SO4)3溶液的浓度相等,溶液中c(SO42-)=3c[Al2(SO4)3],故两溶液中SO42-离子浓度相等,所含SO42-离子浓度之比=1:1;
SO42-离子浓度相等,根据n=cV可知,SO42-离子数目之比=物质的量之比=体积之比=0.2L:0.5L=2:5,
故答案为:1:1;2:5;
(4)20.6g NaR含有Na+0.2mol,NaR的物质的量为0.2mol,NaR的摩尔质量为
| 20.6g |
| 0.2mol |
| 8g |
| 80g/mol |
故答案为:103g/mol;0.1;
(5)由方程式MnO2+4HCl(浓)
| ||
故答案为:0.2;0.2;2.24.
点评:本题考查常用化学计量计算、方程式有关计算,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
用惰性材料作电极,分别电解下列物质,当相同电量时,下列指定的电极上析出气体质量最大的是( )
| A、熔融的NaCl(阳极) |
| B、NaCl溶液(阴极) |
| C、NaOH溶液(阴极) |
| D、Na2SO4(阳极) |
下列描述不符合生产、生活实际的是( )
| A、家用炒锅残留盐溶液时易发生吸氧腐蚀 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、电解水制氢气时,用铜作阳极 |
| D、在镀件上电镀锌,用锌作阳极 |
下列反应属于有机物被还原的是( )
| A、乙醛发生银镜反应 |
| B、新制的氢氧化铜与乙醛的反应 |
| C、乙醛加氢制乙醇 |
| D、乙醛制乙酸 |
下列说法正确的是( )
| A、生石灰与水混合的过程只发生物理变化 |
| B、可用丁达尔效应区分溶液与胶体 |
| C、O3是由3个氧原子构成的化合物 |
| D、CuSO4?5H2O是一种混合物 |
 某石蕊的分子结构如图所示.
某石蕊的分子结构如图所示.