题目内容
12.下列实验现象以及结论正确的是( )| A | 向盐酸酸化的Ba(NO3)2溶液中通入SO2 | 有白色沉淀生成 | BaSO3难溶于酸 |
| B | 向等浓度的KCl、Kl混合液中滴加AgNO3溶液 | 先出现白色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 溴乙烷与NaOH水溶液共热后,加HNO3酸化,滴加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷含溴元素 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性条件下NO3-与SO2发生氧化还原反应生成SO42-;
B.向等浓度的KCl、KI混合液中滴加AgNO3溶液,溶度积常数小的物质先出现沉淀;
C.出现淡黄色沉淀,可说明溴乙烷水解;
D.久置的Na2O2粉末混有碳酸钠.
解答 解:A.酸性条件下NO3-与SO2发生氧化还原反应生成SO42-,生成的沉淀为BaSO4,而不是BaSO3,故A错误;
B.向等浓度的KCl、KI混合液中滴加AgNO3溶液,溶度积常数小的物质先出现沉淀,如果先生成黄色沉淀,说明Ksp(AgCl)>Ksp(AgI),故B正确;
C.溴乙烷在碱性条件下水解,酸化后加入硝酸银溶液可生成溴化银浅黄色沉淀,可证明,故C正确;
D.久置的Na2O2粉末混有碳酸钠,加盐酸生成无色气体中有氧气和二氧化碳,结论不合理,故D错误.
故选BC.
点评 本题考查较为综合,涉及物质的检验和沉淀的转化,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.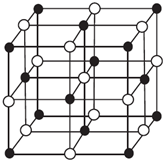 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为F>N>O.(用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为H2O>NH3>CH4(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为平面三角形.
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC-.与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)KFe2(CN)6.
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是TiN>MgO>KCl.MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有6个.
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是Cr2O3.
 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:(1)写出C、D、E三种原子第一电离能由大到小的顺序为F>N>O.(用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为H2O>NH3>CH4(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为平面三角形.
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC-.与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)KFe2(CN)6.
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是Cr2O3.
3.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为NA | |
| B. | 1molNa2O2固体中含阴离子总数为2NA | |
| C. | 5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA | |
| D. | 100mL12mol•L-1浓盐酸与足量MnO2加热反应,转移电子数为1.2NA |
20.n g CO2中有m个O原子,则阿伏加德罗常数NA的数值可表示为( )
| A. | 22m/n mol-1 | B. | m/22n mol-1 | C. | n/32m mol-1 | D. | n/32mmol-1 |
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加石蕊试液显红色的溶液:Fe3+、SO42-、C1-、SCN- | |
| B. | c(Al3+)=0.5mol•L的溶液中:Na+、K+、HCO3-、SO42- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10 的溶液中:SO32-、NH4+、NO3-、K+ | |
| D. | 滴加甲基橙试液呈红色的溶液:NH4+、Ba2+、Al3+、Cl- |
4.除杂(括号内为杂质),请把所加试剂和有关离子方程式填在空白处.
| 试剂 | 离子方程式 | |
| ①NaCl (Na2SO4) | ||
| ②NaCl(MgCl2) | ||
| ③NaCl(Na2CO3) |
2.某有机物和过量钠反应生成气体VaL,另一份等质量的该有机物和碳酸氢钠反应生成VbL气体(同温同压),若Va=Vb,则该有机物可能是( )
| A. | HOCH2CH2COOH | B. | CH3COOH | ||
| C. | HOOC-COOH | D. | 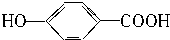 |
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):