题目内容
4.除杂(括号内为杂质),请把所加试剂和有关离子方程式填在空白处.| 试剂 | 离子方程式 | |
| ①NaCl (Na2SO4) | ||
| ②NaCl(MgCl2) | ||
| ③NaCl(Na2CO3) |
分析 ①硫酸钡与氯化钡反应生成硫酸钡和NaCl;
②氯化镁与NaOH反应生成沉淀和氯化钠;
③碳酸钠与盐酸反应生成氯化钠,以此来解答.
解答 解:①硫酸钡与氯化钡反应生成硫酸钡和NaCl,试剂为BaCl2溶液,离子反应为Ba2++SO42-=BaSO4↓;
②氯化镁与NaOH反应生成沉淀和氯化钠,试剂为NaOH溶液,离子反应为Mg2++2OH-=Mg(OH)2↓;
③碳酸钠与盐酸反应生成氯化钠,试剂为稀盐酸,离子反应为2H++CO32-=CO2↑+H2O,
故答案为:
| 试剂 | 化学方程式 | |
| NaCl (Na2SO4) | BaCl2溶液 | Ba2++SO42-=BaSO4↓ |
| NaCl(MgCl2) | NaOH溶液 | Mg2++2OH-=Mg(OH)2↓ |
| NaCl(Na2CO3) | 稀盐酸 | 2H++CO32-=CO2↑+H2O |
点评 本题考查混合物分离提纯,侧重于学生的分析能力的考查,为高考常见题型,注意物质的性质、发生的反应为解答该类题目的关键,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
18.乙苯是一种用途广泛的有机原料,可制备多种化工产产品.
制备苯乙烯(原理如图所示):

(1)部分化学键的键能如下表:
根据反应的能量变化,计算x=612KJ/mol.
(2)工业上,在恒压设备中进行反应时,常在乙苯蒸气中通入一定量的水蒸气,用化学平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率..
制备苯乙烯(原理如图所示):

(1)部分化学键的键能如下表:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应时,常在乙苯蒸气中通入一定量的水蒸气,用化学平衡理论解释通入水蒸气的原因为正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率..
15.原子序数依次增大的五种短周期元素 X、Y、Z、R、T,有关信息如下表.下列说法正确的是( )
| 元素 | X | Y | Z | R | T |
| 原子半径/nm | 0.037 | 0.077 | 0.074 | 0.186 | 0.102 |
| 主要化合价 | +1 | +4、-4 | -2 | +1 | +6、-2 |
| A. | X、Y、Z 位于同一周期 | |
| B. | R 与 Z 所形成的化合物均只含离子键 | |
| C. | 氢化物的沸点:Y<Z<T | |
| D. | 第一电离能:Y<Z |
12.下列实验现象以及结论正确的是( )
| A | 向盐酸酸化的Ba(NO3)2溶液中通入SO2 | 有白色沉淀生成 | BaSO3难溶于酸 |
| B | 向等浓度的KCl、Kl混合液中滴加AgNO3溶液 | 先出现白色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 溴乙烷与NaOH水溶液共热后,加HNO3酸化,滴加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷含溴元素 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
19.要使氯化铝溶液中的Al3+完全转化成Al(OH)3沉淀,应选用的试剂是( )
| A. | 烧碱溶液 | B. | 稀盐酸 | C. | 氨水 | D. | KOH溶液 |
13.某短周期金属元素原子核外最外层电子数是最内层电子数的1.5倍,下列说法正确的是( )
| A. | 该元素的单质性质活泼,具有较强的还原性,可以用于某些金属冶炼 | |
| B. | 该元素的单质常温下不与浓硫酸反应 | |
| C. | 该元素的单质无需特别保存,因为其性质稳定,不易与空气成分反应 | |
| D. | 该元素的最高价氧化物对应的水化物只能与酸反应 |
14.盐A与酸B反应,可放出有气味的气体C,C与NaOH反应生成A;C最终可氧化生成D;D溶于水生成B,则A、B分别是( )
| A. | Na2S和HCl | B. | Na2S和H2SO4 | C. | Na2SO3和HCl | D. | Na2SO3和H2SO4 |

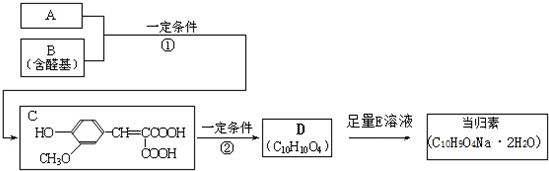
 .
. .
.