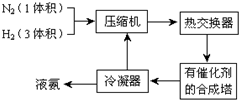
题目内容
15.在一定温度下,将一定量的A、B气体置于容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+2D(g),反应进行到5s末时,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol.求:(1)用C物质表示的该反应的速率;
(2)反应前B的物质的量浓度;
(3)反应5s后,物质A的转化率.(写出计算过程,只有答案不得分)
分析 (1)用C物质表示的该反应的速率=$\frac{\frac{△n}{V}}{△t}$;
(2)5s末时,生成n(C)=0.8mol,则参加反应的n(B)=$\frac{1}{2}$n(C)=$\frac{1}{2}$×0.8mol=0.4mol,则反应前n(B)=0.4mol+0.6mol=1.0mol,则反应前c(B)=$\frac{n}{V}$;
(3)5s末时,生成n(C)=0.8mol,则参加反应的n(A)=$\frac{3}{2}$n(C)=$\frac{3}{2}$×0.8mol=1.2mol,则反应前n(A)=1.8mol+1.2mol=3.0mol,转化率=$\frac{参加反应的n(A)}{反应初始n(A)}×100%$.
解答 解:(1)用C物质表示的该反应的速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.8mol}{2L}}{5s}$=0.08mol/(L.S),
答:用C物质表示的该反应速率为0.08mol/(L.S);
(2)5s末时,生成n(C)=0.8mol,则参加反应的n(B)=$\frac{1}{2}$n(C)=$\frac{1}{2}$×0.8mol=0.4mol,则反应前n(B)=0.4mol+0.6mol=1.0mol,则反应前c(B)=$\frac{n}{V}$=$\frac{1.0mol}{2L}$=0.5mol/L,
答:反应前B的物质的量浓度为0.5mol/L;
(3)5s末时,生成n(C)=0.8mol,则参加反应的n(A)=$\frac{3}{2}$n(C)=$\frac{3}{2}$×0.8mol=1.2mol,则反应前n(A)=1.8mol+1.2mol=3.0mol,转化率=$\frac{参加反应的n(A)}{反应初始n(A)}×100%$=$\frac{1.2mol}{3mol}×100%$=40%,
答:A的转化率为40%.
点评 本题考查化学平衡有关计算,侧重考查学生分析计算能力,明确各个物理量之间的关系、有关公式是解本题关键,题目难度不大.

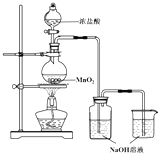 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作a中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:
取此消毒液5g,加入20mL 0.5mol•L-1KI溶液,10mL 2mol•L-1的硫酸溶液;加几滴淀粉溶液后,用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟不恢复.
②此消毒液有效氯含量为1.4%(保留一位有效数字).获得结论:此实验制得的消毒液不符合(填“符合”或“不符合”)家用要求.
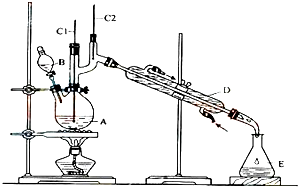 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由不能,浓H2SO4遇水放出大量的热,容易溅出伤人.
(2)加入沸石的作用是防暴沸.若加热后发现未加沸石,应采取的正确方法是停止加热,冷却后补加.
(3)上述装置图中,B的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)B仪器使用前必须进行的操作是C.
a.润湿b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,正丁醛在上层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,为更好的控制温度,可以采取的改进措施是水浴加热.
(7)本实验中,正丁醛的产率为51%.
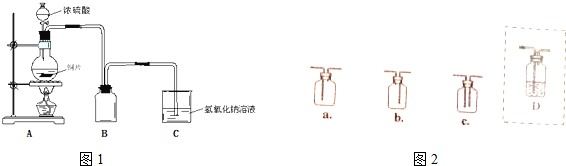
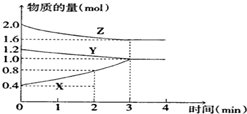 某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析: