题目内容
7.把8mol X 气体和4mol Y 气体混合于2L 密闭容器中,使它们发生如下反应:2X(g)+Y (g)?n Z (g)+2W (g).2min末已生成2mol W,若测知以Z的浓度变化表示的反应速率为0.5mol•(L•min)-1,计算:(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度.
(3)化学反应方程式中n值是多少?
分析 2min末已生成2mol W,则v(W)=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/l/(L•min),反应速率之比等于化学计量数之比即n:2=v(z):v(w)=0.5:0.5,n=2,
2X(g)+Y (g)?2 Z (g)+2W (g)
起始(mol) 8 4 0 0
转化(mol) 2 1 2 2
平衡(mol) 6 3 2 2
以此解答该题.
解答 解:2min末已生成2mol W,则v(W)=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/l/(L•min),反应速率之比等于化学计量数之比即n:2=v(z):v(w)=0.5:0.5,n=2,
2X(g)+Y (g)?2 Z (g)+2W (g)
起始(mol) 8 4 0 0
转化(mol) 2 1 2 2
平衡(mol) 6 3 2 2
(1)前2min内v(X)=v(Z)0.5mol•(L•min)-1,
答:前2min内用X的浓度变化表示的平均反应速率为0.5 mol/(L•min);
(2)2min末时Y的浓度为$\frac{3mol}{2L}$=1.5mol/L,
答:2min末时Y的浓度为1.5 mol/L;
(3)由以上分析可知化学反应方程式中n值为2,
故答案为:化学反应方程式中n值为2.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法计算、速率、浓度的计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 增加A的量,平衡正向移动,达到新平衡时K值增大 | |
| B. | 升高温度,K值增大 | |
| C. | K越大,说明该反应的进行程度越大 | |
| D. | 该反应的K=$\frac{{c}^{m}(A)+cn(B)}{{c}^{p}(C)+{c}^{q}(D)}$ |
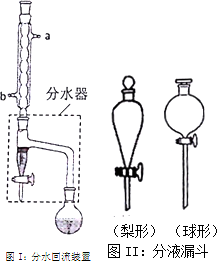 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2OH$?_{△}^{H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O
制备过程中还可能的副反应有:
CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2CH2CH2CH3+H2O
主要实验步骤如下:
①在干燥的圆底烧瓶中加11.5mL正丁醇、7.2mL冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再如图Ⅰ装置安装好分水器、冷凝管.然后小火加热.
②将烧瓶中反应后的混后物冷却与分水器中的酯层合并,转入分液漏斗,
③依次用10mL水,10mL 10%碳酸钠溶液洗至无酸性(pH=7),再水洗一次,用少许无水硫酸镁干燥.
④将干燥后的乙酸正丁酯转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度(g•cm-3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点(℃) | 118.0 | 118.1 | 126.1 | 142 |
(1)图I装置中冷水应从b(填a或b),管口通入,反应混合物冷凝回流,通过分水器下端旋塞分出的生成物是水,其目的是分离酯化反应生成的水,使平衡正向移动,提高反应产率.
(2)在步骤①④中都用到沸石防暴沸,下列关于沸石的说法正确的是AD.
A.实验室沸石也可用碎瓷片等代替
B.如果忘加沸石,可速将沸石加至将近沸腾的液体中
C.当重新进行蒸馏时,用过的沸石可继续使用
D.沸石为多孔性物质,可使液体平稳地沸腾
(3)在步骤③分液时,应选择图II装置中梨形分液漏斗,其原因是梨形分液漏斗靠近旋塞处比较细长,双液界面更清晰,分离更完全.
(4)在提纯粗产品的过程中,用碳酸钠溶液洗涤主要除去的杂质乙酸、硫酸、正丁醇.若改用氢氧化钠溶液是否可以不可以(填“可以”或“不可以”),其原因用氢氧化钠溶液会使乙酸正丁酯发生水解.
(5)步骤④的常压蒸馏,需收集126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂.

| A. | △H>0 | B. | △H<0 | C. | △H=0 | D. | 无法判断 |

 .
.