题目内容
20.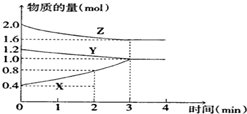 某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:(1)该反应的化学方程式为Y+2Z?3X.
(2)反应开始至2min末,X的反应速率为0.1mol/(L•min).
(3)该反应是由正逆反应同时开始的.(填“正反应”“逆反应”“正、逆反应同时”)
(4)若增加Y的用量,化学反应速率不变化,则Y为固体或纯液态.
(5)在一个体积不变的密闭容器中发生可逆反应:A(s)+2B(g)?C(g)+D(g),在恒温下,当下列物理量不再变化时,表明上述可逆反应已达到平衡状态的是②.
①混合气体的压强 ②混合气体的密度 ③混合气体的体积 ④气体的总物质的量.
分析 (1)随着反应的进行,Y、Z的物质的量减少而X的物质的量增多,说明Y、Z是反应物而X是生成物,3min时反应达到平衡状态,参加反应的n(Y)=(1.2-1.0)mol=0.2mol、n(Z)=(2.0-1.6)mol=0.4mol、n(X)=(1.0-0.4)mol=0.6mol,同一可逆反应中同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,据此确定方程式;
(2)反应开始至2min末,X的反应速率=$\frac{\frac{△n}{V}}{△t}$;
(3)根据图知,0min时反应物和生成物都含有,所以正逆反应都有;
(4)增加固体或纯液体不改变平衡移动;
(5)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变.
解答 解:(1)随着反应的进行,Y、Z的物质的量减少而X的物质的量增多,说明Y、Z是反应物而X是生成物,3min时反应达到平衡状态,参加反应的n(Y)=(1.2-1.0)mol=0.2mol、n(Z)=(2.0-1.6)mol=0.4mol、n(X)=(1.0-0.4)mol=0.6mol,同一可逆反应中同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,所以Y、Z、X的计量数之比=0.2mol:0.4mol:0.6mol=1:2:3,所以该反应方程式为Y+2Z?3X,
故答案为:Y+2Z?3X;
(2)反应开始至2min末,X的反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(0.8-0.4)mol}{2L}}{2min}$=0.1 mol/(L•min),
故答案为:0.1 mol/(L•min);
(3)根据图知,0min时反应物和生成物都含有,所以正逆反应都有,故答案为:正逆反应同时;
(4)增加固体或纯液体不改变平衡移动,加入Y物质平衡不移动,说明Y为固体或纯液体,故答案为:固体或纯液;
(5)①反应前后气体的物质的量不变,所以压强始终不变,当混合气体的压强不变时不能判断平衡状态,故错误;
②反应前后气体的质量增加但容器体积不变,所以反应前后气体的密度增大,当混合气体的密度不变时该反应达到平衡状态,故正确;
③反应前后气体的物质的量不变,所以混合气体的体积始终不变,所以不能判断平衡状态,故错误;
④反应前后气体的总物质的量不变,所以不能判断平衡状态,故错误;
故选②.
点评 本题考查化学平衡计算及化学平衡状态判断,为高频考点,侧重考查学生分析判断计算能力,注意:固体和纯液体没有浓度,其量的多少不影响平衡移动,注意(5)为易错点.

| A. | 溴乙烷和乙酸乙酯 | B. | 乙醇和乙酸 | ||
| C. | 乙醇和乙酸乙酯 | D. | 苯乙烯和氯甲烷 |
2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O
实验流程如图1:
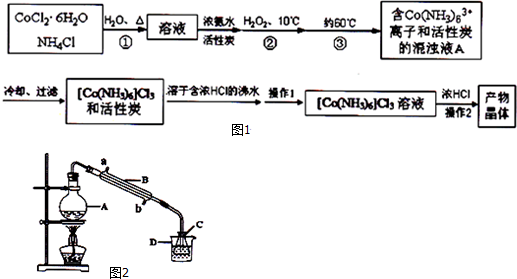
已知:[Co(NH3)6]Cl3 在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
| 温度(℃) | 0 | 20 | 47 |
| 溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是加速固体溶解.
(2)H2O2的作用是做氧化剂,第③步中保持60℃的加热方法是水浴加热.
(3)过滤是滤纸先用蒸馏水湿润,然后用玻璃棒压实滤纸,排出滤纸与漏斗之间的气泡.
(4)实验操作1为趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl的目的是有利于[Co(NH3)6]Cl3析出,提高产率.
(5)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:
[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl(装置见图2),
C中装0.5000mol/L的盐酸25.00mL,D中装有冰水.加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2~3滴甲基红指示剂,用0.5000mol/L的NaOH滴定.已知:
| 指示剂 | 颜色 | 变色的pH范围 | ||
| 甲基红 | 红 | 橙 | 黄 | 4.4~6.2 |
②当滴定到终点时,共需消耗NaOH溶液13.00mL(精确到0.01mL)
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将偏大(填“偏大”、“偏小”或“不变”).
| A. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多 | |
| B. | 热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(g)△H=-1256 kJ•mol-1,可知乙炔的燃烧热为1256 kJ•mol-1 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
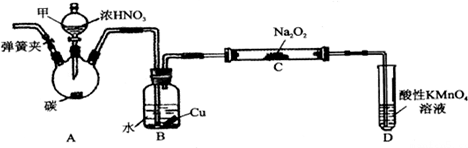
 一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:

 .
.