题目内容
15.如图纵坐标代表沉淀的质量,横坐标代表加入溶液的体积,符合下列图象的是( )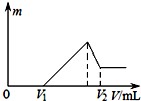
| A. | 向硫酸溶液中加入氢氧化钡溶液 | |
| B. | 向碳酸氢钠溶液中加入氯化钙 | |
| C. | 向硫酸、硫酸镁、硫酸铝的混合溶液中逐滴加入氢氧化钠溶液直至过量 | |
| D. | 向氯化铝溶液中加入过量氢氧化钠溶液 |
分析 根据曲线表示的意思一开始加入乙物质并没有气体或沉淀产生而要加入到一定量的时候才开始产生沉淀或气体分析选项中的物质之间的反应关系来解答此题.注意很重要的一点:酸碱盐各物质之间混合时酸和碱之间会优先反应.
解答 解:A、向硫酸溶液中加入氢氧化钡溶液,一开始就有沉淀,故A错误;
B、向碳酸氢钠溶液中加入氯化钙,不反应,所以不符合图象,故B错误;
C、向硫酸、硫酸镁、硫酸铝的混合溶液中加入氢氧化钠溶液,氢氧化钠溶液会优先与稀硫酸反应生成可溶于水的硫酸钠和水,没有气体或沉淀生成.等与稀硫酸反应完后,氢氧化钠才与硫酸镁和硫酸铝反应生成氢氧化镁沉淀、氢氧化铝沉淀和可溶于水的硫酸钠,完全沉淀再加氧氧化钠,氢氧化铝溶解,符合曲线所表示的意义,故C选;
D、向氯化铝溶液中加入过量氢氧化钠溶液,一开始就有沉淀,故D错误;故选C.
点评 解答本题很重要的一个知识点多种物质混合时发生反应的优先权问题.一般情况下酸和碱发生的中和反应具有优先反应的权利.同时要抓住曲线的起点、转折点和终点可快速解题.

练习册系列答案
相关题目
7.下列反应的离子方程式中正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 铁屑溶于稀盐酸中:2Fe+6H+═2Fe3++3H2↑ |
6.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| A. | 放电时锌做负极 | |
| B. | 充电时电池的正极和电源的正极相连 | |
| C. | 充电时氢氧化铁被氧化 | |
| D. | 放电时每转移3 mol e-,有2 mol FeO42-被还原 |
3.20mL0.02mol•L-1 KMnO4溶液恰好与20mL0.05mol•L-1 Na2SO3溶液完全反应,则Mn在还原产物中的化合价是:(提示:Na2SO3在反应中被氧化成Na2SO4)( )
| A. | 0 | B. | +2 | C. | +3 | D. | +6 |
10.下列说法正确的是( )
| A. | 1mol任何气体的体积都约为22.4L | |
| B. | 22.4L水在标况下的质量为18g | |
| C. | 2L 1mol/L Na2CO3溶液中Na+浓度为4mol/L | |
| D. | 从1L NaCl溶液中取出100mL,其浓度与原1L溶液相同 |
20.有关下列四个常用电化学装置的叙述中,正确的是( )
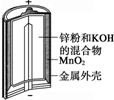 | 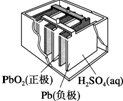 | 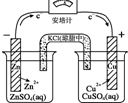 | 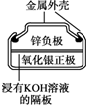 |
| Ⅰ.碱性锌锰电池 | Ⅱ.铅-硫酸蓄电池 | Ⅲ.铜锌原电池 | Ⅳ.银锌纽扣电池 |
| A. | Ⅰ所示电池工作中,MnO2的作用是催化剂 | |
| B. | Ⅱ所示电池放电过程中,硫酸浓度不断增大 | |
| C. | Ⅲ所示电池工作过程中,盐桥中K+移向硫酸锌溶液 | |
| D. | Ⅳ所示电池放电过程中,Ag2O是氧化剂,电池工作过程中还原为Ag |
7.常温下用惰性电极电解NaHSO4溶液,电解一段时间后,下列有关电解质溶液变化的说法正确的是( )
| A. | 电解质溶液的浓度增大,pH减小 | B. | 电解质溶液的浓度增大,pH增大 | ||
| C. | 电解质溶液的浓度减小,pH减小 | D. | 电解质溶液的浓度不变,pH不变 |
3.下列说法正确的是( )
| A. | 原子序数越大,原子半径一定越大 | |
| B. | 电子层数多的原子半径一定比电子层数少的原子半径大 | |
| C. | 元素性质的周期性变化不是元素性质的简单重复 | |
| D. | 按C、N、O、F的顺序,元素的最高正价依次升高 |