题目内容
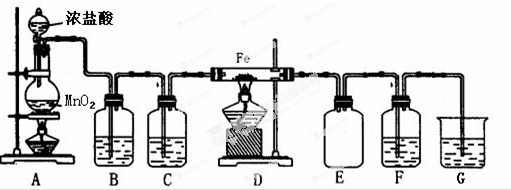
5.已知::①2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | Na2O2(s)与CO2(g)反应时,放出226kJ热量 | |
| B. | CO的燃烧热为△H=-566kJ/mol | |
| C. | CO(g)与Na2O2 (S)反应的热化学方程式为:Na2O2(s)+CO(g)═Na2CO3(s)△H=-509kJ•mol-1 | |
| D. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)△H=-452kJ•mol-1 |
分析 A、物质的量不知,所以放出的热量大小不知;
B、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量分析计算判断;
C、根据盖斯定律利用题给热化学方程式合并消去二氧化碳得到热化学方程式;
D、气态二氧化碳转变成固态要吸热.
解答 解:A、参与反应的物质的量不知,所以放出的热量大小不知,故A错误;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,CO的燃烧热为283kJ/mol,故B错误;
C、已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol ②Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
,根据盖斯定律合并热化学方程式得到,$\frac{②×2+①}{2}$得到的热化学方程式为 CO(g)+Na2O2(s)=2Na2CO3(s);△H=-509kJ/mol,故C正确;
D、根据热化学方程式为Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol,又气态二氧化碳转变成固态要吸热,则2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452kJ/mol,故D错误;
故选C.
点评 本题考查了热化学方程式的书写判断,燃烧热的概念应用,反应焓变的意义,盖斯定律的应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.硅是无机非金属材料的主角,硅芯片的使用,促进了信息技术的革命.
(1)陶瓷、水泥和玻璃都属于传统硅酸盐材料.其中,生产普通玻璃的主要原料除了SiO2、Na2CO3外还CaCO3.玻璃制作过程中发生了Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生?高温下Na2SiO3的稳定性比Na2CO3强.
(2)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
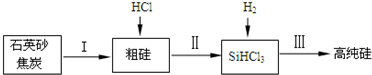
①请写出反应Ⅱ、Ⅲ的化学方程式:ⅡSi+3HCl$\frac{\underline{\;\;△\;\;}}{\;}$SiHCl3+H2、ⅢSiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
②在流化床反应的产物中,SiHCl3大约占85%,所含有的其它物质的沸点数据如下表:
提纯SiHCl3的主要工艺操作依次是沉降、冷凝和分馏(相当于多次蒸馏).沉降是为了除去Si;在空气中冷凝所得液体主要含有SiCl4、SiHCl3;若在实验室进行分馏提纯液体,应该采取以下加热方法中的D;
A.电炉加热 B.酒精灯加热 C.砂浴加热 D.水浴加热
③SiHCl3极易水解,其完全水解时的反应方程式为SiHCl3+4H2O=H4SiO4+H2↑+3HCl.
(1)陶瓷、水泥和玻璃都属于传统硅酸盐材料.其中,生产普通玻璃的主要原料除了SiO2、Na2CO3外还CaCO3.玻璃制作过程中发生了Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生?高温下Na2SiO3的稳定性比Na2CO3强.
(2)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:

①请写出反应Ⅱ、Ⅲ的化学方程式:ⅡSi+3HCl$\frac{\underline{\;\;△\;\;}}{\;}$SiHCl3+H2、ⅢSiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
②在流化床反应的产物中,SiHCl3大约占85%,所含有的其它物质的沸点数据如下表:
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
A.电炉加热 B.酒精灯加热 C.砂浴加热 D.水浴加热
③SiHCl3极易水解,其完全水解时的反应方程式为SiHCl3+4H2O=H4SiO4+H2↑+3HCl.
13.以下分散系,不会出现丁达尔现象的是( )
| A. | 鸡蛋清溶液 | B. | 淀粉溶液 | C. | 食盐水 | D. | 雾 |
19.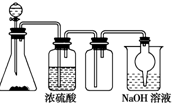 如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是
如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是
( )
 如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是
如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是( )
| A. | MnO2和浓盐酸 | B. | Na2SO3(s)和较浓H2SO4 | ||
| C. | Cu片和浓HNO3 | D. | 浓氨水和生石灰 |
 .
.