题目内容
19.下列各组离子在溶液中能大量共存的是( )| A. | Ba2+、Cu2+、NO3-、SO42- | B. | K+、Na+、SO42-、Cl- | ||
| C. | CO32-、H+、Na+、K+ | D. | H+、Cl-、NO3-、Ag+ |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子在溶液中能大量共存,以此来解答.
解答 解:A.Ba2+、CO32-反应生成沉淀而不能大量共存,故A错误;
B.该组离子之间不反应,能够大量共存,故B正确;
C.CO32-、H+反应生成二氧化碳和水,不能大量共存,故C错误;
D.Cl-、Ag+反应生成沉淀而不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存问题,为高考常见题型,侧重于学生的分析能力的考查,注意把握常见离子的性质以及反应类型的判断,熟悉复分解反应发生的条件及常见物质的溶解性即可解答,难度不大.

练习册系列答案
相关题目
9.X+的核外电子排布为2、8、8,则X元素在周期表中的位置是( )
| A. | 第三周期第0族 | B. | 第四周期第ⅠA族 | C. | 第三周期第ⅠA族 | D. | 第三周期第ⅦA族 |
10.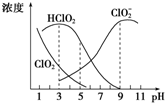 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO${\;}_{2}^{-}$、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO${\;}_{2}^{-}$、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )
 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO${\;}_{2}^{-}$、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO${\;}_{2}^{-}$、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数约为Ka=10-6 | |
| C. | 25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合(忽略Cl-),则混合溶液中有c(HClO2)+2c(H+)═c(ClO${\;}_{2}^{-}$)+2c(OH-) | |
| D. | 使用该漂白剂的最佳pH为3 |
14.下列物质的沸点按由高到低的顺序排列正确的是( )
①CH3(CH2)3CH3
②CH3(CH2)4CH3
③C(CH3)4
④(CH3)2CHCH2CH3.
①CH3(CH2)3CH3
②CH3(CH2)4CH3
③C(CH3)4
④(CH3)2CHCH2CH3.
| A. | ②①④③ | B. | ②③④① | C. | ③④①② | D. | ①④③② |
11.为保护好蓝天白云,减轻“雾霾”,应采用的措施是( )
| A. | 尽量使用化石燃料 | B. | 尽力发展清洁能源 | ||
| C. | 增加工厂烟囱高度 | D. | 夜间排放工业废气 |
8.设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 标准状况下,11.2LC5H12含有的分子数为0.5NA | |
| B. | 21g乙烯与丁烯的混合气体中含有3NA个C-H键 | |
| C. | 1L0.1mol/LNH4NO3溶液中含有0.2NA个N | |
| D. | 光照下,1molCl2与足量CH4完全反应,生成NA个HCl |
19.下列叙述正确的是( )
| A. | 1.7克-OH中含有的电子数为NA | |
| B. | 42g乙烯与丙烯的混合气体中含碳原子数为3NA | |
| C. | 二氯乙烯的结构简式:CH2=C(Cl)2 | |
| D. | 乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧气的分子数一定为0.6 NA |
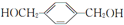 ,其所含官能团名称为羟基.
,其所含官能团名称为羟基. .
. ,
,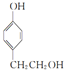 ,
,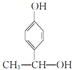 ,
,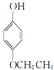 .
.