题目内容
家庭厨房炒菜用的锅主要是铁锅(铁碳合金)和铝锅.炒过菜的铁锅洗净后未及时擦干,第二天便出现红棕色锈斑[该锈斑为Fe(OH)3失水的产物],使用有关原电池原理、电极方程式、化学方程式,离子方程式表示Fe(OH)3和锈斑的形成.
(1)铁锅发生的是电化腐蚀中的 腐蚀,电极方程式为:
①正极 ②负极
(2)生成Fe(OH)3的化学方程式 .
(3)Fe(OH)3失水的化学方程式 .
(4)钢材焊接时必须除去钢材表面的铁锈,用稀盐酸除去铁锈的离子方程式为 .
(1)铁锅发生的是电化腐蚀中的
①正极
(2)生成Fe(OH)3的化学方程式
(3)Fe(OH)3失水的化学方程式
(4)钢材焊接时必须除去钢材表面的铁锈,用稀盐酸除去铁锈的离子方程式为
考点:金属的电化学腐蚀与防护,铁的氧化物和氢氧化物
专题:电化学专题
分析:(1)根据电化学腐蚀分为吸氧腐蚀和析氢腐蚀,当电解质溶液是酸性时,发生析氢腐蚀,当电解质溶液是弱酸性或中性时,发生吸氧腐蚀,而炒过菜的锅有NaCl溶液残留,故发生的是吸氧腐蚀,负极铁放电,正极氧气放电,据此写出正负极反应方程式;
(2)将正负极反应相加即得总反应,然后根据Fe(OH)2极易被氧气氧化得Fe(OH)3写出反应;
(3)Fe(OH)3失水变为铁锈Fe2O3?XH2O,据此写出失水的化学方程式;
(4)铁锈为Fe2O3的结晶水合物,与盐酸发生复分解反应,据此写出离子方程式.
(2)将正负极反应相加即得总反应,然后根据Fe(OH)2极易被氧气氧化得Fe(OH)3写出反应;
(3)Fe(OH)3失水变为铁锈Fe2O3?XH2O,据此写出失水的化学方程式;
(4)铁锈为Fe2O3的结晶水合物,与盐酸发生复分解反应,据此写出离子方程式.
解答:
解:(1)炒过菜的锅有NaCl溶液残留,是中性溶液中,钢铁中碳、铁和电解质溶液构成原电池发生吸氧腐蚀,负极上铁失电子生成二价铁离子,故电极反应式为Fe-2e-=Fe2+;正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-,
故答案为:Fe-2e-=Fe2+;O2+4e-+2H2O=4OH-;
③亚铁离子和氢氧根离子反应生成氢氧化亚铁氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁4Fe(OH)2+O2+2H2O=4Fe(OH)3,最后,氢氧化铁失去部分水生成带结晶水 的氧化铁Fe2O3.xH2O,即铁锈的主要成分.
故答案为:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)Fe(OH)3失水变为Fe2O3?XH2O,故化学方程式为:2Fe(OH)3=Fe2O3?XH2O+(3-X)H2O,故答案为:2Fe(OH)3=Fe2O3?XH2O+(3-X)H2O;
(4)铁锈为Fe2O3的结晶水合物,与盐酸发生复分解反应:Fe2O3+6HCl=2FeCl3+3H2O,根据能拆的物质有强酸、强碱和可溶性盐可知,离子方程式为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O.
故答案为:Fe-2e-=Fe2+;O2+4e-+2H2O=4OH-;
③亚铁离子和氢氧根离子反应生成氢氧化亚铁氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁4Fe(OH)2+O2+2H2O=4Fe(OH)3,最后,氢氧化铁失去部分水生成带结晶水 的氧化铁Fe2O3.xH2O,即铁锈的主要成分.
故答案为:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)Fe(OH)3失水变为Fe2O3?XH2O,故化学方程式为:2Fe(OH)3=Fe2O3?XH2O+(3-X)H2O,故答案为:2Fe(OH)3=Fe2O3?XH2O+(3-X)H2O;
(4)铁锈为Fe2O3的结晶水合物,与盐酸发生复分解反应:Fe2O3+6HCl=2FeCl3+3H2O,根据能拆的物质有强酸、强碱和可溶性盐可知,离子方程式为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O.
点评:本题考查了金属的电化学腐蚀的正负极反应和铁锈的形成和离子方程式的书写,根据电解质溶液的性质来判断钢铁发生的是析氢腐蚀还是吸氧腐蚀,难度不大.

练习册系列答案
相关题目
下列化学用语正确的是( )
A、聚丙烯的结构简式: |
B、2-甲基-1-丁烯分子的键线式: |
C、四氯化碳分子的电子式: |
D、丙烷分子的比例模型: |
糖类、油脂、蛋白质是人类基本营养物质,关于糖类、油脂、蛋白质的说法错误的是( )
| A、单糖都可以发生银镜反应 |
| B、氨基酸、多肽、蛋白质都具有两性 |
| C、油脂皂化是取代反应,硬化是加成反应 |
| D、淀粉、纤维素、蛋白质都是天然高分子 |
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 产物 | 产物 |
| ① | Cl2 | FeBr2 | / | Cl- | |
| ② | KClO3 | 浓盐酸 | / | Cl2 |
| A、反应①中可能有一种或两种元素被氧化 |
| B、反应①中,当只有少量Cl2时,反应可表示为Cl2+Fe2+═Fe3++2Cl- |
| C、反应②中KClO3被氧化,HCl被还原 |
| D、若反应②的另一种产物是KCl,则反应过程中1molKClO3得到6mole- |
两种气态烃的混合气体共0.5mol,在空气中燃烧得到0.8mol二氧化碳和18g水,关于该混合气体的说法合理的是( )
| A、一定含甲烷,不含乙烷 |
| B、一定含乙烷,不含甲烷 |
| C、一定是甲烷和乙烯的混合物 |
| D、一定含甲烷,不含乙烯 |
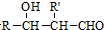
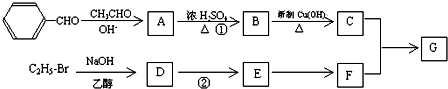
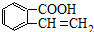 、
、