题目内容
6.在标准状况下,体积为4.48L的CO和CO2的混合气体共7.2g(1)CO的质量为2.8g.
(2)CO的体积为2.24L.
(3)混合气体的平均摩尔质量为36g•mol-1.
(4)混合气体的密度为1.61g•L-1. (小数点后保留1位)
分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体的总的物质的量,设CO的物质的量为x,CO2的物质的量为y,根据质量之和与物质的量之和列式计算可求得气体的物质的量,
(1)根据m=nM计算出CO的质量;
(2)根据n=nVm计算出CO的体积;
(3)根据M=$\frac{m}{n}$计算出混合气体的平均摩尔质量;
(4)根据ρ=$\frac{m}{V}$计算出混合气体的密度.
解答 解:标准状况下,混合气体的物质的量为:$\frac{4.4L}{22.4L/mol}$=0.2mol,
设CO的物质的量为x,CO2的物质的量为y,则28x+44y=7.2、x+y=0.2mol,解得:x=0.1mol、y=0.1mol,
(1)混合气体中含有0.1molCO,含有CO的质量为:28g/mol×0.1mol=2.8g,
故答案为:2.8;
(2)标准状况下0.1molCO的体积为:22.4L/mol×0.1mol=2.24L,
故答案为:2.24;
(3)混合气体的物质的量为0.2mol,则混合气体的平均摩尔质量为:$\frac{7.2g}{0.2mol}$=36g/mol,
故答案为:36;
(4)混合气体的密度为:ρ=$\frac{7.2g}{4.48L}$≈1.61g/L,
故答案为:1.61.
点评 本题考查物质的量的计算,题目难度不大,注意相关计算公式的运用,也可以通过平均相对分子质量利用十字交叉法计算二者的物质的量之比,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
16.下列图象分别表示有关反应的反应过程与能量变化的关系
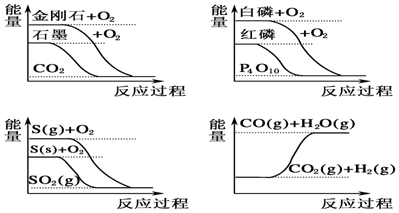
据此判断下列说法中正确的是( )

据此判断下列说法中正确的是( )
| A. | CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | 石墨转变为金刚石是吸热反应 |
17.CPAE是蜂胶的主要活性成分,它由咖啡酸合成,合成过程如下.下列说法不正确的是( )
 +
+ →
→ +H2O.
+H2O.
 +
+ →
→ +H2O.
+H2O.| A. | 1molCPAE和1mol咖啡酸分别与足量的NaOH溶液反应,均最多消耗3molNaOH | |
| B. | 与苯乙醇互为同分异构体的酚类物质共有9种 | |
| C. | FeCl3溶液可区别咖啡酸和CPAE | |
| D. | 咖啡酸可发生聚合反应,并且其分子中含有3种官能团 |
14.设NA为阿伏加德罗常数的值,则下列说法正确的是( )
| A. | 1mol苯酚中“C═C”的个数为3 NA | |
| B. | 常温常压下,22.4L丙烷所含有的共价键数目为10NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$ NA | |
| D. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
1.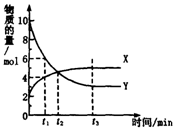 一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
 一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | 根据t2时的数据,可求出该温度下的平衡常数 | |
| D. | t3时,逆反应速率大于正反应速率 |
11.下列各组离子在强碱性溶液中,可以大量共存的是( )
| A. | Na+、Ba2+、AlO2-、NO3- | B. | K+、Na+、HSO3-、Cl- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Fe3+、Na+、ClO-、S2- |
18.对于HD的描述,不正确的是( )
| A. | 在受热条件下,HD能还原氧化铜 | |
| B. | HD能在氯气中燃烧生成HCl和DCl气体 | |
| C. | 是一种非金属单质 | |
| D. | 是一种化合物 |
3.25℃时,分别向20mL 0.1mol/L两种一元酸HX和HY溶液中滴加入0.1mol/LNaOH溶液,所得溶液pH随加入的NaOH溶液体积变化如图.

下列说法中正确的是( )

下列说法中正确的是( )
| A. | V1=20mL,V2>20mL | |
| B. | A点之后至B点之前的溶液中,一定是:c(X- )>c( Na+)>c(H+)>c(OH- ) | |
| C. | 若V1=10mL,C点的溶液中,一定是:c(HY )-c( Y-)=2[c(OH- )-c(H+)] | |
| D. | D点以后的溶液中,一定是:c( Na+)>c(OH- )>c(Y- )>c(H+) |