题目内容
8.一个原电池反应是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的( )| A | B | C | D | |
| 正极 | Zn | Ag | C | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 由电池反应式Zn+Cu2+═Zn2++Cu知,锌失电子发生氧化反应,作负极;不如锌活泼的金属或导电的非金属作正极,正极上铜离子得电子发生还原反应,则电解质溶液中应含有铜离子,所以应为可溶性的铜盐,据此进行解答.
解答 解:由电池反应式Zn+Cu2+═Zn2++Cu知,锌失电子发生氧化反应,作负极;不如锌活泼的金属或导电的非金属作正极,正极上铜离子得电子发生还原反应,则电解质溶液中应含有铜离子,所以应为可溶性的铜盐,
A.锌应作负极,铜作正极,故A错误;
B.该装置不能自发的进行氧化还原反应,故B错误;
C.该装置中,锌易失电子作负极,铜作正极,电解质溶液为可溶性的铜盐,符合条件,故C正确;
D.电解质溶液中不含铜离子,故D错误;
故选C.
点评 本题考查了原电池原理,难度不大,明确原电池的构成条件是解本题关键,注意根据方程式中发生的反应类型判断原电池的正负极及电解质溶液.

练习册系列答案
相关题目
19.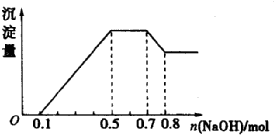 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A. | 溶液中一定不含有CO32-,可能含有SO42-和NO3- | |
| B. | 溶液中n(NH4+)=0.2mol | |
| C. | C.溶液中的阳离子只有H+、Mg2+、Al3+ | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
20.下列物质中,既含有离子键又含有共价键的是( )
| A. | KOH | B. | LiCl | C. | H2 | D. | NH3 |
17.下列离子方程式正确的是( )
| A. | 浓烧碱溶液中加入铝片:Al+2OH-═AlO2-+H2↑ | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使SO42-全部沉淀:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在2 mol/L FeBr2溶液80 mL中通入4.48 L氯气(标况下),充分反应:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
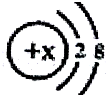 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3. 电石气的结构式H-C≡C-H
电石气的结构式H-C≡C-H .
. .
. .
.