题目内容
1.工业上用乙烯和氯气为原料合成聚氯乙烯(PVC).已知次氯酸能跟乙烯发生加成反应:CH2=CH2+HClO→CH2(OH)CH2Cl.以乙烯为原料制取PVC等产品的转化关系如图所示.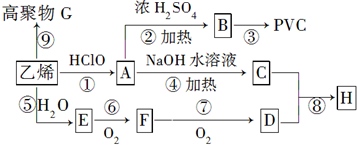
试回答下列问题:
(1)写出有机物B和G的结构简式:BCH2=CHCl,G
 ;
;(2)②、⑤、⑦的反应类型分别是消去反应,加成反应,氧化反应;
(3)写出D的一种同分异构体的结构简式HCOOCH3、CH2(OH)CHO(任写一种);
(4)写出反应⑥的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(5)E的核磁共振氢谱有三个峰,峰面积之比为:1:2:3(由小到大).
(6)写出C与D按物质的量之比为1:2反应生成H的化学方程式:CH2OHCH2OH+2CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
分析 乙烯发生加聚反应得到高聚物G为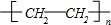 ,乙烯与水发生加成反应生成E为CH3CH2OH,乙醇在催化剂条件下发生氧化反应生成F为CH3CHO,CH3CHO可进一步氧化得到D为CH3COOH,反应①为乙烯与次氯酸发生加成反应生成A为HOCH2CH2Cl,A发生水解反应生成C为HOCH2CH2OH,(6)中C与D按物质的量之比为1:2反应生成H,则H为CH3COOCH2CH2OOCCH3,A发生消去反应生成B为CH2=CHCl,B在发生加聚反应得到PVC为
,乙烯与水发生加成反应生成E为CH3CH2OH,乙醇在催化剂条件下发生氧化反应生成F为CH3CHO,CH3CHO可进一步氧化得到D为CH3COOH,反应①为乙烯与次氯酸发生加成反应生成A为HOCH2CH2Cl,A发生水解反应生成C为HOCH2CH2OH,(6)中C与D按物质的量之比为1:2反应生成H,则H为CH3COOCH2CH2OOCCH3,A发生消去反应生成B为CH2=CHCl,B在发生加聚反应得到PVC为 ,据此分析解答.
,据此分析解答.
解答 解:乙烯发生加聚反应得到高聚物G为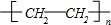 ,乙烯与水发生加成反应生成E为CH3CH2OH,乙醇在催化剂条件下发生氧化反应生成F为CH3CHO,CH3CHO可进一步氧化得到D为CH3COOH,反应①为乙烯与次氯酸发生加成反应生成A为HOCH2CH2Cl,A发生水解反应生成C为HOCH2CH2OH,(6)中C与D按物质的量之比为1:2反应生成H,则H为CH3COOCH2CH2OOCCH3,A发生消去反应生成B为CH2=CHCl,B在发生加聚反应得到PVC为
,乙烯与水发生加成反应生成E为CH3CH2OH,乙醇在催化剂条件下发生氧化反应生成F为CH3CHO,CH3CHO可进一步氧化得到D为CH3COOH,反应①为乙烯与次氯酸发生加成反应生成A为HOCH2CH2Cl,A发生水解反应生成C为HOCH2CH2OH,(6)中C与D按物质的量之比为1:2反应生成H,则H为CH3COOCH2CH2OOCCH3,A发生消去反应生成B为CH2=CHCl,B在发生加聚反应得到PVC为 ,
,
(1)通过以上分析知,B是CH2=CHCl,G是 ,故答案为:CH2=CHCl;
,故答案为:CH2=CHCl; ;
;
(2)②、⑤、⑦的反应类型分别是消去反应、加成反应、氧化反应,故答案为:消去反应;加成反应;氧化反应;
(3)乙酸的同分异构体有甲酸甲酯和CH2(OH)CHO,结构简式分别为:HCOOCH3,CH2(OH)CHO,故答案为:HCOOCH3、CH2(OH)CHO(任写一种);
(4)反应⑥为乙醇的催化氧化反应,该反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(5)E为CH3CH2OH,E的核磁共振氢谱有3个吸收峰,吸收峰面积之比为1:2:3,故答案为:1:2:3;
(6)C与D按物质的量之比为1:2反应生成H的化学方程式为CH2OHCH2OH+2CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O,
故答案为:CH2OHCH2OH+2CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH2OOCCH3+2H2O.
点评 本题考查了有机物的推断,为高频考点,侧重考查学生推断能力,根据物质含有的官能团推测其具有的性质,结构决定性质,难点是书写同分异构体,注意有官能团异构和位置异构.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| C. | 实验中需用2.0 mol•L-1的Na2 CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL,201.4 g | |
| D. | 中和滴定时,左手控制滴定管活塞,右手握持锥形瓶,眼睛注视锥形瓶中溶液颜色的变化 |
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃10mL 4mol/L的X溶液 | ||
| C. | 20℃30mL 2mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |
| A. | Fe和盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 石灰石和盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| A. | X和Y的总能量一定低于M和N的总能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X的能量一定低于M的,Y的能量一定低于N的 |
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. |  2-甲基丁烯 2-甲基丁烯 | D. | 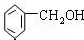 苯甲醇 苯甲醇 |
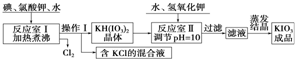
请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:②除去反应生成的氯气,有利于反应正反应方向进行
(请从化学平衡角度解释).
(3)已知几种物质的溶解度见下表:
| KCl | KH(IO3)2 | KClO3 | |
| 溶解度g/100g水(25℃) | 20.8 | 0.8 | 7.5 |
| 溶解度g/100g水(80℃) | 37.1 | 12.4 | 16.2 |
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是使KH(IO3)2转化为KIO3.
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0mol•L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00mL,则成品中KIO3的质量分数为85.6%(列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,I2+2Na2S2O3═2NaI+Na2S4O6).
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
②根据乙同学的实验结果推测,甲同学的实验结果会偏大(填“偏大”,“偏小”或“无影响”).
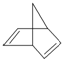 ,其分子式为C7H8.
,其分子式为C7H8. .
.