题目内容
6.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )| A. | X和Y的总能量一定低于M和N的总能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X的能量一定低于M的,Y的能量一定低于N的 |
分析 A.反应物的总能量低于生成物的总能量时反应是吸热反应;
B.吸热反应不一定在加热的条件下发生,反应放热还是吸热与反应条件无关,决定于反应物互为生成物的能量高低;
C.反应中断键时吸收的能量比形成化学键时放出的能量高,则反应是吸热反应.
D.反应热取决于反应物与生成物的总能量,而不是某一种反应物或生成物的能量关系.
解答 解:A.X+Y=M+N为是一个吸热反应,说明反应物的能量低于生成物的总能量,即X和Y的总能量一定低于M和N的总能量,故A正确;
B.吸热反应不一定在加热的条件下发生,比如氯化铵和十水合氢氧化钡的反应就是吸热反应,但是不需条件就能发生,故B错误;
C.断裂旧键需要吸热能量,形成新键会放出能量,该反应是吸热反应,则反应中断键时吸收的能量大于形成化学键时放出的能量,故C错误;
D.X+Y=M+N为是一个吸热反应,说明反应物的能量低于生成物的总能量,不能说明X的能量一定低于M的能量,Y的能量一定低于N的能量,故D错误;
故选A.
点评 本题考查吸热反应与放热反应,注意掌握反应热与焓变的关系,明确化学反应与能量变化之间的关系,B为易错点,注意反应热与反应条件之间没有必然关系.

练习册系列答案
相关题目
14.如图所示是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( )

| A. | X和W位于同一主族 | |
| B. | 原子半径:Y>Z>X | |
| C. | 盐YRX与化合物WX2的漂白原理相同 | |
| D. | Y和R两者的最高价氧化物对应的水化物能相互反应 |
15.在溶液中能大量共存的离子组是( )
| A. | Fe3+、OH一、HCO3- | B. | Ba2+、OH一、C1- | C. | H+、K+、CO32-、 | D. | NH4+、NO3-、OH- |
11.下列热化学方程式或叙述正确的是( )
| A. | 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642kJ的热量:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol-1 | |
| B. | 12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ•mol-1 | |
| C. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ•mol-1,则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ•mol-1 | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 |
15.下列叙述中正确的是( )
| A. | 液态HBr不导电,因此HBr是非电解质 | |
| B. | 强电解质溶液的导电性不一定很强 | |
| C. | NH3的水溶液能导电,因此NH3是电解质 | |
| D. | 强电解质在液态时一定能导电 |
16.下列物质中,与NaOH溶液、Na2CO3、溴水、苯酚钠水溶液和甲醇都能反应的是( )
| A. | 苯 | B. | CH3CHO | C. | CH3COOH | D. | CH2=CH-COOH |
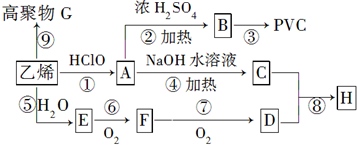
 ;
;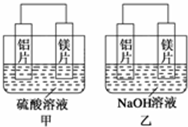 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.