题目内容
13.下列说法正确的是( )| A. | SiH4比CH4稳定 | |
| B. | O2- 半径比F- 的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | P和S属于第三周期的元素,H3PO4酸性比H2SO4的弱 |
分析 A.同主族自上而下,非金属性减弱,非金属性越弱,对应的氢化物的稳定性越小;
B.核外电子排布相同时,原子序数越小,半径越大;
C.碱金属从上到下,元素的金属性逐渐增强,失去电子能力增强;
D.非金属性越强,对应的最高价含氧酸的酸性越强.
解答 解:A.同主族自上而下,非金属性减弱,非金属性C>Si,非金属性越弱,对应的氢化物的稳定性越小,稳定性:CH4>SiH4,故A错误;
B.核外电子排布相同时,原子序数越小,半径越大,所以O2-半径比F-的大,故B错误;
C.Cs是第ⅠA族元素,为碱金属,Cs失电子能力比Na的强,故C正确;
D.非金属性S>P,非金属性越强,对应的最高价含氧酸的酸性越强,酸性:H2SO4>H3PO4,故D正确.
故选CD.
点评 本题考查元素性质的比较,为高频考点,把握元素的金属性、非金属性比较为解答的关键,注意元素的位置及元素周期律的应用,题目难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
3.下列不是由于胶体的性质而产生的现象的是( )
| A. | 石膏能使豆浆变成豆腐 | |
| B. | 明矾净水 | |
| C. | 花粉在水面上做布朗运动 | |
| D. | 太阳光照在弥漫灰尘的室内,可看到从窗口到地面出现一条光亮的通路 |
4.下列叙述正确的是( )
| A. | 含1molNa2S的溶液,最多可吸收2molSO2 | |
| B. | 可以用浓硫酸除去镀在铝表面的铜镀层 | |
| C. | Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
1.决定化学反应速率快慢的主要因素是( )
| A. | 温度 | B. | 浓度 | C. | 催化剂 | D. | 反应物的性质 |
8.关于下列装置说法正确的是( )
| A. |  盐桥中的K+移向ZnSO4溶液 | |
| B. | 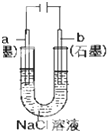 工作一段时间后,a极附近溶液的C(OH-)增大 | |
| C. | 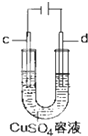 工作时,c极为发生氧化反应 | |
| D. |  电子由Zn流向Fe,装置中有Fe2+生成 |
5. 在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )
在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )
 在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )
在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )| A. | 在t5时,容器NO2的体积分数是整个过程中的最大值 | |
| B. | 在t2时,采取的措施可以是增大压强 | |
| C. | 在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态 | |
| D. | 在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态 |
2.在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法错误的是( )

| A. | 标准状况下当甲中产生4.48 L气体时,丙中Cu电极质量增加21.6g | |
| B. | 电解过程中丙中溶液pH无变化 | |
| C. | 向甲中加入适量的盐酸,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-═Cu |
3.氯水中存在如下平衡:Cl2(g)?Cl2(aq)、Cl2(aq)+H2O?H++Cl-+HClO.下列说法正确的是( )
| A. | 向饱和氯水中通入HCl,有c(H+)═c(Cl-)+c(OH-)+c(ClO-) | |
| B. | 氯气在1mol•L-1的NaCl溶液中比在1mol•L-1的AlCl3溶液中的溶解度小 | |
| C. | 光照,氯水的漂白性增强 | |
| D. | 若向饱和氯水中通入少量H2S,则$\frac{c({H}^{+})}{c(ClO^-)}$减小 |
 现有A、B两种金属分别与盐酸反应,产生氢气的速率相近.请设计一个原电池实验证明A、B两种金属的活动性?(电极材料:A、B,电解质溶液:盐酸,其它实验用品可自选),请在方框中画出简易装置图.如A是较不活泼的金属,则A的现象是有气泡逸出,那么,B即是活泼的金属.
现有A、B两种金属分别与盐酸反应,产生氢气的速率相近.请设计一个原电池实验证明A、B两种金属的活动性?(电极材料:A、B,电解质溶液:盐酸,其它实验用品可自选),请在方框中画出简易装置图.如A是较不活泼的金属,则A的现象是有气泡逸出,那么,B即是活泼的金属.