题目内容
2.下列除去杂质的方法不正确的是( )| A. | 除去Na2CO3固体中少量NaHCO3:加热 | |
| B. | 除去CO2中少量SO2:通过饱和NaHCO3溶液 | |
| C. | 除去氯气中少量氯化氢:通过氢氧化钠溶液 | |
| D. | 除去氧化铁中少量氧化铝:加入过量的烧碱溶液后,过滤 |
分析 A.碳酸氢钠加热分解生成碳酸钠;
B.二氧化硫与碳酸氢钠反应生成二氧化碳;
C.二者均与NaOH反应;
D.氧化铝与NaOH反应,而氧化铁不能.
解答 解:A.碳酸氢钠加热分解生成碳酸钠,则加热法可除杂,故A正确;
B.二氧化硫与碳酸氢钠反应生成二氧化碳,则通过饱和NaHCO3溶液、洗气可除杂,故B正确;
C.二者均与NaOH反应,不能除杂,应选饱和食盐水除杂,故C错误;
D.氧化铝与NaOH反应,而氧化铁不能,则加入过量的烧碱溶液后,过滤,故D正确.
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
18.现在含有元素硒(Se)的保健品已经开始进入市场,已知它与氧元素同族,与K同周期,关于硒的说法中不正确的是( )
| A. | 原子序数为34 | |
| B. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| C. | Br的非金属性比Se强 | |
| D. | 气态氢化物的还原性比硫化氢气体弱 |
13. 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )| A. | 芥子醇分子中有两种含氧官能团 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面上 | |
| C. | 芥子醇与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 芥子醇能发生的反应类型有氧化、还原、取代、加成、聚合 |
10.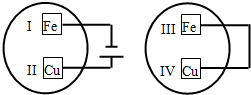 把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )
把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )
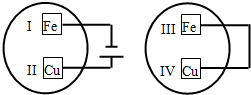 把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )
把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )| A. | II和III附近 | B. | II和IV附近 | C. | I和III附近 | D. | I和IV附近 |
17.下列叙述中正确的是( )
| A. | O22-与S2-具有相同的质子数和电子数 | |
| B. | H、D、T互为同位素,H2O、D2O、T2O互为同素异形体 | |
| C. | 碱金属元素是指 IA族的所有元素 | |
| D. | 周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 |
 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
 ,I
,I .
. ;D→G
;D→G ;E与新制银氨溶液反应
;E与新制银氨溶液反应 .
.