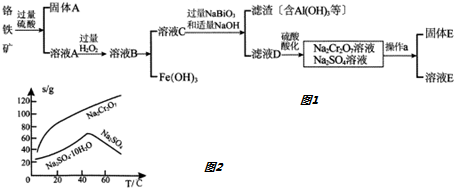
题目内容
18.现在含有元素硒(Se)的保健品已经开始进入市场,已知它与氧元素同族,与K同周期,关于硒的说法中不正确的是( )| A. | 原子序数为34 | |
| B. | 最高价氧化物的水化物的分子式为:H2SeO4 | |
| C. | Br的非金属性比Se强 | |
| D. | 气态氢化物的还原性比硫化氢气体弱 |
分析 A.Se属于第VIA族元素,主族元素最外层电子数与其族序数相等,比硫元素的原子序数大18;
B.Se元素最高正价为+6价,和S属于同一主族,根据S元素确定其最高价氧化物的水化物化学式;
C.同一周期元素,元素的非金属性随着原子序数增大而增强;
D.元素的非金属性越强,其气态氢化物的还原性越弱.
解答 解:A.S的原子序数为16,Se属于第VIA族元素,在硫的一个周期,比硫元素的原子序数大18,主族元素最外层电子数与其族序数相等,则Se的原子序数为16+18=34,故A正确;
B.Se元素最高正价为+6价,和S属于同一主族,根据S元素确定其最高价氧化物的水化物化学式为H2SeO4,故B正确;
C.同一周期元素,元素的非金属性随着原子序数增大而增强,Br和Se属于同一周期元素,且原子序数Br>Se,所以Br的非金属性比Se强,故C正确;
D.元素的非金属性越强,其气态氢化物的还原性越弱,非金属性S>Se,所以气态氢化物的还原性比硫化氢气体强,故D错误;
故选D.
点评 本题考查元素周期律知识,明确同一周期、同一主族元素周期律内涵即可解答,知道元素非金属性强弱与其气态氢化物的还原性关系,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
9.下列有机物检验方法能达到实验目的是( )
| A. | 取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 | |
| B. | 除去乙烷中混有乙烯,将混合气体通入酸性高锰酸钾溶液 | |
| C. | 用燃烧的方法鉴别甲烷与乙炔 | |
| D. | 用溴水鉴别苯和甲苯 |
13.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1molCH3COONa中含有的共用电子对总数为8NA | |
| B. | 标准状况下,将22.4LCl2溶于水,反应转移电子数为NA | |
| C. | 450℃时,在催化剂的作用下,将2molSO2与一定量的O2混合反应,一段时间后测得SO2消耗了$\frac{1}{2}$,则该正反应消耗了NA个SO2分子 | |
| D. | 78gNa2O2和Na2S的混合物中含有的阴离子数目一定是NA |
4. 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如下表:
(1)该同学的实验目的是探究反应物本身的性质对反应速率的影响;
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热.已知:
P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
则白磷转化为红磷的热化学方程式为P4(s,白磷)═4P(s,红磷)△H=-29.2kJ•mol-1. 相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).)
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热.已知:
P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
则白磷转化为红磷的热化学方程式为P4(s,白磷)═4P(s,红磷)△H=-29.2kJ•mol-1. 相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).)
2.下列除去杂质的方法不正确的是( )
| A. | 除去Na2CO3固体中少量NaHCO3:加热 | |
| B. | 除去CO2中少量SO2:通过饱和NaHCO3溶液 | |
| C. | 除去氯气中少量氯化氢:通过氢氧化钠溶液 | |
| D. | 除去氧化铁中少量氧化铝:加入过量的烧碱溶液后,过滤 |
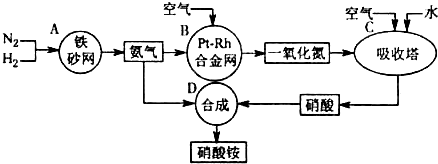
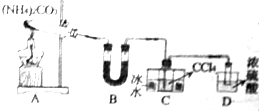 尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.
尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.