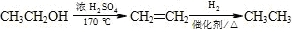题目内容
14.A、B、C、D、E、F的原子序数依次增大,它们都具有相同的核外电子层数.已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3.(1)写出下列元素的符号:ANa,BMg,EP.
(2)把B的单质(片状)放入滴有酚酞的沸水中,观察到的现象产生气体,溶液变红,反应的化学方程式是Mg+2H2O═Mg(OH)2+H2↑.
(3)A、C两种元素的最高价氧化物的水化物反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
分析 A、B、C、D、E、F的原子序数依次增大,它们都具有相同的核外电子层数,则均为同周期.已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,则C为Al,A为Na,F的最外层电子为11-3-1=7,即F为Cl;D元素原子的最外层电子数比次外层电子数少4,D为Si;E元素原子次外层电子数比最外层电子数多3,E为P,然后结合元素周期律及元素化合物知识来解答.
解答 解:A、B、C、D、E、F的原子序数依次增大,它们都具有相同的核外电子层数,则均为同周期.已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,则C为Al,A为Na,F的最外层电子为11-3-1=7,即F为Cl;D元素原子的最外层电子数比次外层电子数少4,D为Si;E元素原子次外层电子数比最外层电子数多3,E为P,B在A、C之间,可知B为Mg,
(1)由上述分析可知,A、B、E分别为Na、Mg、P,故答案为:Na;Mg;P;
(2)把B的单质(片状)放入滴有酚酞的沸水中,观察到的现象产生气体,溶液变红,反应的化学方程式是Mg+2H2O═Mg(OH)2+H2↑,
故答案为:产生气体,溶液变红;Mg+2H2O═Mg(OH)2+H2↑;
(3)A、C两种元素的最高价氧化物的水化物反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构推断元素为解答的关键,侧重分析与推断能力的考查,注意元素周期律及元素化合物知识的应用,题目难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
4. 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如下表:
(1)该同学的实验目的是探究反应物本身的性质对反应速率的影响;
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热.已知:
P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
则白磷转化为红磷的热化学方程式为P4(s,白磷)═4P(s,红磷)△H=-29.2kJ•mol-1. 相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).)
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热.已知:
P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
则白磷转化为红磷的热化学方程式为P4(s,白磷)═4P(s,红磷)△H=-29.2kJ•mol-1. 相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).)
5.不能说明元素X的电负性比元素Y的大的是( )
| A. | X原子的最外层电子数比Y原子最外层电子数多 | |
| B. | X的最高价氧化物水化物的酸性比Y的最高价氧化物水化物的酸性强 | |
| C. | 与H2化合时X形成的单质比Y形成的单质容易 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
2.下列除去杂质的方法不正确的是( )
| A. | 除去Na2CO3固体中少量NaHCO3:加热 | |
| B. | 除去CO2中少量SO2:通过饱和NaHCO3溶液 | |
| C. | 除去氯气中少量氯化氢:通过氢氧化钠溶液 | |
| D. | 除去氧化铁中少量氧化铝:加入过量的烧碱溶液后,过滤 |
19.最近报道了一种锂离子电池,它在放电时有关离子转化关系如图所示,下列说法错误的是( )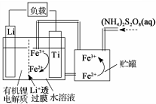

| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O32-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的正极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe2+=Li+Fe3+ |
3.下列表达方式错误的是( )
| A. | S2-的结构示意图: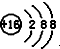 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | O-18原子的符号:${\;}_{8}^{18}$O | |
| D. | CO2分子的结构式:O=C=O |
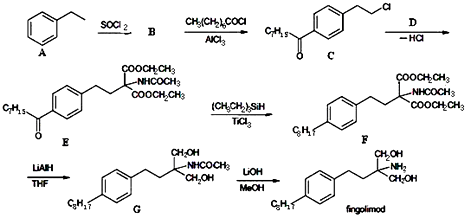
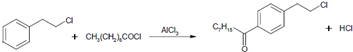 .
.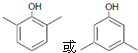 .
.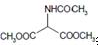 等主要原料,合成医药中间体:
等主要原料,合成医药中间体: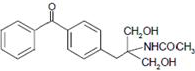 (无机原料任选).合成路线流程图示例如下:
(无机原料任选).合成路线流程图示例如下: