题目内容
4.有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1.B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:(1)由这五种元素组成的一种化合物是(写化学式)KAl(SO4)2•12H2O.
(2)写出C元素基态原子的电子排布式1s22s22p63s23p1.
(3)用电子排布式表达式表示B元素原子的价电子构型2s22p4.
(4)元素B与D的电负性的大小关系是O>S,C与E的第一电离能的大小关系是Al>K.(用元素符号和“>或<或﹦”表示 )
(5)DB2是由极性键构成的极性(填“极性”或“非极性”)分子;分子空间构型是V型.
分析 A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;由B和D属于同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,电子排布为2s22p4或3s23p4,结合核电荷数可知B为O,D为S;A和E属同一族,它们原子的最外层电子排布为ns1,结合核电荷数及E为金属元素可知,E为K,A为H;C原子最外层上电子数等于D原子最外层上电子数的一半,C的最外层电子数为3,由核电荷数可知为第三周期元素,则C为Al,以此来解答.
解答 解:由上述分析可知,A为H,B为O,C为Al,D为D,E为K,
(1)由这五种元素组成的一种化合物是KAl(SO4)2•12H2O,俗称明矾,故答案为:KAl(SO4)2•12H2O;
(2)C元素基态原子的电子排布式为1s22s22p63s23p1,故答案为:1s22s22p63s23p1;
(3)B最外层电子数为6,用电子排布式表达式表示B元素原子的价电子构型为2s22p4,故答案为:2s22p4;
(4)非金属性越强,电负性越大,则B与D的电负性的大小关系是O>S,金属性越强,第一电离能越小,则C与E的第一电离能的大小关系是Al>K,
故答案为:O>S;Al>K;
(5)DB2为SO2,S原子价层电子对数=2+$\frac{6-2×2}{2}$=3,S原子含有1对孤电子对,为sp2杂化,分子构型为V型,且含S、O之间的极性键,为极性分子,
故答案为:极性;极性;V型.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素在周期表的位置、原子序数、原子结构、电子排布规律来推断元素为解答的关键,侧重分析与应用能力的考查,注意物质结构与性质的应用,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
13. 常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
 常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )
常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH体积V的关系如图所示,下列说法正确的是( )| A. | HR为强电解质 | |
| B. | 图中四点,水的电离程度:c>b>d>a | |
| C. | 若常温时,0.1mol/LHR溶液的电离度为1%,则常温时R+的水解常数约为10-9 | |
| D. | b点溶液中存在c(Na+)=c(R+)+c(HR) |
14.在体积为1L密闭容器中充入3mol的H2和1mol的N2,经测定反应开始后3s末的v(H2)=0.3mol/(L•s),则3s末H2的浓度为( )
| A. | 0.9mol/L | B. | 1.8mol/L | C. | 2.1mol/L | D. | 1.2mol/L |

 +
+ =Fe2O3+5H2O
=Fe2O3+5H2O 向负极迁移
向负极迁移 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
 .
. .
. ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应. (填结构简式).
(填结构简式).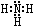 ;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为
;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为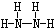 .若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.
.若64g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-1500kJ/mol.