题目内容
5.下列说法正确的是( )| A. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| B. | 乙烯与溴发生加成反应的产物为溴乙烷 | |
| C. | n=7,主链上有5个碳原子的烷烃共有五种 | |
| D. | 1mol苯恰好与3mol氢气完全加成,说明一个苯分子中有三个碳碳双键 |
分析 A.烷烃的通式为CnH2n+2,C元素的质量分数为$\frac{12n}{14n+2}$=$\frac{12}{14+\frac{2}{n}}$;
B.乙烯中含碳碳双键,与溴发生加成反应;
C.n=7,主链上有5个碳原子的烷烃,支链为2个甲基或1个乙基,可以看作取代戊烷形成的物质;
D.苯中不含碳碳双键.
解答 解:A.烷烃的通式为CnH2n+2,C元素的质量分数为$\frac{12n}{14n+2}$=$\frac{12}{14+\frac{2}{n}}$,则随n值增大,碳元素的质量百分含量逐渐增大,故A错误;
B.乙烯中含碳碳双键,可与溴水发生加成反应生成1,2-二溴乙烷,故B错误;
C.n=7,主链上有5个碳原子的烷烃,支链为2个甲基或1个乙基,符合的有(CH3)3CCH2CH2CH3、CH3CH2C(CH3)2CH2CH3、CH3CH2CH(CH2CH3)CH2CH3、(CH3)2CHCH2CH(CH3)2、(CH3)2CHCH(CH3)CH2CH3,共5种,故C正确;
D.苯中不含碳碳双键,但1 mol摩尔苯恰好与3摩尔氢气完全加成,故D错误;
故选C.
点评 本题考查有机物的结构与性质,选项C为解答的易错点,注意减链法书写同分异构体,注重基础知识的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列对应的图形正确的是( )
| A. | 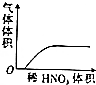 稀HNO3滴入Na2SO3溶液中 | B. | 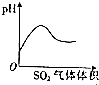 SO2气体通入新制氯水中 | ||
| C. | 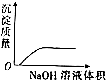 NaOH溶液滴入Ba(HCO3)2溶液中 | D. | 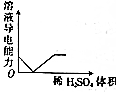 稀H2SO4滴入Ba(OH)2溶液中 |
16.水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O.下列说法中正确的是( )
| A. | 2molFe2+被氧化时有1molO2被还原 | B. | 该反应中只有Fe2+是还原剂 | ||
| C. | 每生成1molFe3O4转移2mol电子 | D. | 反应方程式中化学计量数x=2 |
13.科学家研制出了一种新型的贮氢材料-.这种镁铝合金的成分可表示为Mg17Al12.其贮氢和释氢的原理可表示为:Mg17Al12+17H2$?_{释氢}^{储氢}$17MgH2+12Al,下列有关说法正确的是( )
| A. | Mg17Al12是离子化合物 | |
| B. | 为防止金属氧化,熔炼制备Mg17Al12时通氮气做保护气 | |
| C. | 732 g的合金能吸收380.8 L氢气 | |
| D. | 该合金的熔点比镁和铝的熔点低 |
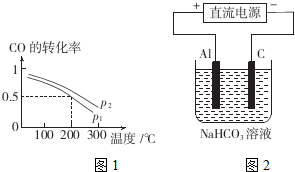
10. 已知反应:CO(g)+3H2(g)?CH4(g)+H2O(g).起始以物质的量之比为1:1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲).下列有关说法正确的是( )
已知反应:CO(g)+3H2(g)?CH4(g)+H2O(g).起始以物质的量之比为1:1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲).下列有关说法正确的是( )
 已知反应:CO(g)+3H2(g)?CH4(g)+H2O(g).起始以物质的量之比为1:1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲).下列有关说法正确的是( )
已知反应:CO(g)+3H2(g)?CH4(g)+H2O(g).起始以物质的量之比为1:1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲).下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | N点时的反应速率一定比M点快 | |
| C. | 降低温度,H2的转化率可达到100% | |
| D. | 工业用此法制取甲烷应采用更高的压强 |
14.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L 0.5mol/LNa2S溶液中含有的S2-个数为NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA |
15.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 等质量的N2和CO所含分子数均为NA | |
| B. | 一定温度下,1 L 1 mol•L-1的CH3COONa溶液含NA个CH3COO- | |
| C. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含的电子数均为10NA |