题目内容
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 .
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景.
工业上可用如下方法合成甲醇:
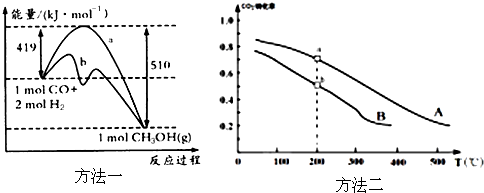
①方法一:该反应的△S 0(填“>”或“<”).图中曲线a到曲线b的措施是 ,恒温恒容时,下列说法能说明反应到达平衡状态的是 .
A.体系的平均摩尔质量不再改变 B.V(CO)=V(CH3OH)
C.H2的转化率达到了最大限度 D.△H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为: ;a,b两点化学反应速率别用Va、Vb表示,则Va Vb(填“大于”、“小于”或“等于”). 已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法一的原子利用率是方法二的原子利用率的 倍(保留两位小数).
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.写出除去甲醇的离子方程式 .
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
写出表示甲醇燃烧热的热化学方程式
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景.
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |

①方法一:该反应的△S
A.体系的平均摩尔质量不再改变 B.V(CO)=V(CH3OH)
C.H2的转化率达到了最大限度 D.△H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为:
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.写出除去甲醇的离子方程式
考点:热化学方程式,反应热和焓变,常见化学电源的种类及其工作原理,用化学平衡常数进行计算,化学平衡的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,根据盖斯定律将已知热化学方程式进行运算解答.
(2)①依据反应中生成气体或者气体系数增加的反应是熵增加的反应判断反应的熵变;
依据使用催化剂改变反应历程,降低该反应的活化能解答;
结合反应CO(g)+2H2(g)?CH3OH(g)的特点分析解答.
A.依据平均摩尔质量=
,结合气体总质量和气体总的物质的量变化分析;
B.V(CO)=V(CH3OH)不能说明V正=V逆;
C.H2的转化率是个变量,只有达到平衡才能保持不变据此分析解答;
D.方程式确定后,该反应的焓变是个定值;
(3)平衡常数等于生成物浓度幂之积/反应物浓度幂之积;温度相同时,依据压强与二氧化碳的转化率关系判断A、B所在曲线的压强高低,结合温度多速率的影响判断Va与Vb;依据原子利用率=期望产物的总质量与生成物的总质量之比解答;
(4)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写方程式.
(2)①依据反应中生成气体或者气体系数增加的反应是熵增加的反应判断反应的熵变;
依据使用催化剂改变反应历程,降低该反应的活化能解答;
结合反应CO(g)+2H2(g)?CH3OH(g)的特点分析解答.
A.依据平均摩尔质量=
| m总 |
| n总 |
B.V(CO)=V(CH3OH)不能说明V正=V逆;
C.H2的转化率是个变量,只有达到平衡才能保持不变据此分析解答;
D.方程式确定后,该反应的焓变是个定值;
(3)平衡常数等于生成物浓度幂之积/反应物浓度幂之积;温度相同时,依据压强与二氧化碳的转化率关系判断A、B所在曲线的压强高低,结合温度多速率的影响判断Va与Vb;依据原子利用率=期望产物的总质量与生成物的总质量之比解答;
(4)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写方程式.
解答:
解:(1)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ?mol-1
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
根据盖斯定律
得到CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol;
(2)①CO(g)+2H2(g)?CH3OH(g)该反应为气体系数减小的反应所以△S<0;
由图中曲线a到曲线b可知,反应的焓变不变,反应活化能降低,所以改变的条件为使用催化剂;
恒温恒容时对于反应CO(g)+2H2(g)?CH3OH(g),
A.反应前后气体质量守恒,气体物质的量只有达到平衡时才能保持不变,所以平均摩尔质量=
是个变量只有达到平衡才能保持不变,故A正确;
B.V(CO)=V(CH3OH)不能说明正逆反应速率相等,故B错误;
C.H2的转化率是个变量,当转化率达到了最大限度即消耗的氢气等于生成的氢气时反应达到平衡状态,故C正确;
D.方程式确定后,该反应的焓变是个定值,与是否达到平衡状态无关,故D错误;
故答案为:<;使用催化剂;AC;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)该反应的平衡常数表达式为:K=
;
温度相同时,增大压强,平衡向正反应方向移动,则CO2的转化率增大,所以曲线A所在点压强高为0.5MP,有A点温度高与B点,所以Va大于Vb;
方法一原子利用率为=
×100%=100%;
方法二原子利用率为=
×100%=64%;
=1.56,所以方法一的原子利用率是方法二的原子利用率1.56倍,
故答案为:K=
;大于;1.56;
(4)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
根据盖斯定律
| ①+②×2 |
| 2 |
| 3 |
| 2 |
故答案为:CH3OH(g)+
| 3 |
| 2 |
(2)①CO(g)+2H2(g)?CH3OH(g)该反应为气体系数减小的反应所以△S<0;
由图中曲线a到曲线b可知,反应的焓变不变,反应活化能降低,所以改变的条件为使用催化剂;
恒温恒容时对于反应CO(g)+2H2(g)?CH3OH(g),
A.反应前后气体质量守恒,气体物质的量只有达到平衡时才能保持不变,所以平均摩尔质量=
| m总 |
| n总 |
B.V(CO)=V(CH3OH)不能说明正逆反应速率相等,故B错误;
C.H2的转化率是个变量,当转化率达到了最大限度即消耗的氢气等于生成的氢气时反应达到平衡状态,故C正确;
D.方程式确定后,该反应的焓变是个定值,与是否达到平衡状态无关,故D错误;
故答案为:<;使用催化剂;AC;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)该反应的平衡常数表达式为:K=
| [CH3OH][H2O] |
| [CO2][H2]3 |
温度相同时,增大压强,平衡向正反应方向移动,则CO2的转化率增大,所以曲线A所在点压强高为0.5MP,有A点温度高与B点,所以Va大于Vb;
方法一原子利用率为=
| 32g |
| 28g+4g |
方法二原子利用率为=
| 32g |
| 44g+6g |
| 100% |
| 64% |
故答案为:K=
| [CH3OH][H2O] |
| [CO2][H2]3 |
(4)以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
点评:本题考查了盖斯定律求反应热,化学平衡状态的判断及影响因素,平衡常数表达式的书写,离子方程式的书写,题目综合性强,涉及到的考点都是高考常考的知识点,难度较大,侧重学生综合能力的培养.

练习册系列答案
相关题目
已知某有机样品3.1g 完全燃烧,燃烧后的混合物通过过量的澄清石灰水,石灰水共增重7.1g,经过滤得10g 沉淀.该有机物的分子式可能是( )
| A、C2H6O2 |
| B、C2H6O |
| C、C2H4O2 |
| D、C2H4O |
下列物质含分子最多的是( )
| A、1.204×1024个O2 |
| B、3molCO2 |
| C、标准状况下89.6LCl2 |
| D、90g水 |
下列物质的电子式书写正确的是( )
A、N2: |
B、CO2: |
C、Na2O: |
D、HCl: |
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下: 在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7.其中A、C两元素原子的次外层电子数为8,B、D两元 素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高.
在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7.其中A、C两元素原子的次外层电子数为8,B、D两元 素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高.