题目内容
某同学用氯化钠固体配制0.4mol/L的NaCl溶液500mL,回答下列问题:
(1)所需仪器为:烧杯、托盘天平、药匙、胶头滴管,还需要哪些玻璃仪器才能完成该实验,请写出:
① ,② .
(2)完成该实验步骤 ①计算 ②称量NaCl g ③ ④转移 ⑤洗涤并转移 ⑥定容 ⑦摇匀
(3)下列情况对所配制的CuSO4溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.容量瓶用蒸馏洗涤后残留有少量的水
B.所用过的烧杯、玻璃棒未洗涤
C.定容时俯视刻度线
D.振荡,摇匀溶液后,发现液面低于刻度线,再补加水 .
(1)所需仪器为:烧杯、托盘天平、药匙、胶头滴管,还需要哪些玻璃仪器才能完成该实验,请写出:
①
(2)完成该实验步骤 ①计算 ②称量NaCl
(3)下列情况对所配制的CuSO4溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.容量瓶用蒸馏洗涤后残留有少量的水
B.所用过的烧杯、玻璃棒未洗涤
C.定容时俯视刻度线
D.振荡,摇匀溶液后,发现液面低于刻度线,再补加水
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据配制NaCl溶液的步骤选用仪器,然后判断还缺少的玻璃仪器;
(2)根据配制一定物质的量浓度的溶液步骤进行解答;根据500mL 0.4mol/L的NaCl溶液中氯化钠的物质的量计算出质量,注意托盘天平的最小读数为0.1g;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
分析判断.
(2)根据配制一定物质的量浓度的溶液步骤进行解答;根据500mL 0.4mol/L的NaCl溶液中氯化钠的物质的量计算出质量,注意托盘天平的最小读数为0.1g;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
| n |
| V |
解答:
解:(1)配制的溶液为500mL 0.4mol/L的氯化钠溶液;根据配制步骤可知,配制该溶液需要的仪器有:托盘天平、量筒、烧杯、500mL容量瓶、玻璃棒、胶头滴管等,还缺少的玻璃仪器为:500mL容量瓶和玻璃棒,
故答案为:500mL容量瓶、玻璃棒;
(2)配制的溶液为500mL 0.4mol/L的氯化钠溶液,需要氯化钠的质量为:0.4mol/L×0.5L=0.2mol,需要氯化钠的质量为:58.5g/mol×0.2mol=11.7 g,需要称量氯化钠的质量为:11.7 g;配制该溶液的步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,
故答案为:11.7;溶解;
(3)A.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
B.溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,少量硫酸铜沾在烧杯壁与玻璃棒上,硫酸铜的实际质量减小,所配溶液浓度偏小;
C.定容时,俯视刻度线,导致溶液体积偏小,所配溶液浓度偏大;
D.振荡,摇匀溶液后,发现液面低于刻度线,再补加水,导致溶液体积偏大,所配溶液浓度偏小;
故答案为:A.无影响 B.偏小;C.偏大;D.偏小.
故答案为:500mL容量瓶、玻璃棒;
(2)配制的溶液为500mL 0.4mol/L的氯化钠溶液,需要氯化钠的质量为:0.4mol/L×0.5L=0.2mol,需要氯化钠的质量为:58.5g/mol×0.2mol=11.7 g,需要称量氯化钠的质量为:11.7 g;配制该溶液的步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,
故答案为:11.7;溶解;
(3)A.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
B.溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,少量硫酸铜沾在烧杯壁与玻璃棒上,硫酸铜的实际质量减小,所配溶液浓度偏小;
C.定容时,俯视刻度线,导致溶液体积偏小,所配溶液浓度偏大;
D.振荡,摇匀溶液后,发现液面低于刻度线,再补加水,导致溶液体积偏大,所配溶液浓度偏小;
故答案为:A.无影响 B.偏小;C.偏大;D.偏小.
点评:本题考查溶液的配制,难度不大,关键清楚溶液配制的原理,通过c=
可以加深理解.
| n |
| V |

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
参照反应Br+H2?HBr+H的能量对应反应历程的示意图,下列叙述中正确的是( )
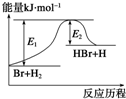

| A、正反应为吸热反应 |
| B、吸热反应一定要加热后才能发生 |
| C、反应物总能量高于生成物总能量 |
| D、升高温度可增大正反应速率,降低逆反应速率 |
下列与化学反应能量变化相关的叙述中正确的是( )
| A、已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802 kJ/mol,甲烷的燃烧热为802 kJ/mol |
| B、等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多 |
| C、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
| D、由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 |
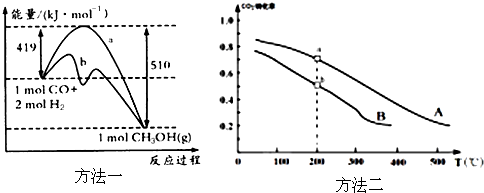
 (1)氢能作为一种新型能源具有燃烧热值高、资源丰富、燃烧产物无污染等优点.已知燃烧4g H2生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式
(1)氢能作为一种新型能源具有燃烧热值高、资源丰富、燃烧产物无污染等优点.已知燃烧4g H2生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式