题目内容
已知某有机样品3.1g 完全燃烧,燃烧后的混合物通过过量的澄清石灰水,石灰水共增重7.1g,经过滤得10g 沉淀.该有机物的分子式可能是( )
| A、C2H6O2 |
| B、C2H6O |
| C、C2H4O2 |
| D、C2H4O |
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:根据石灰水共增重7.1g,为燃烧生成的二氧化碳与水的质量,10g沉淀为碳酸钙的质量,根据元素守恒,计算C元素、H元素的质量,再根据质量守恒判断有机物中是否含有氧元素,最后确定有机物的最简式,结合选项判断.
解答:
解:CaCO3的物质的量为
=0.1mol,根据碳元素守恒可知,产生的二氧化碳为0.1mol,二氧化碳的质量为0.1mol×44g/mol=4.4g,其中碳元素质量为:0.1mol×12g/mol=1.2g,石灰水增重7.1g,所以有机物燃烧生成的水的质量为:7.1-4.4=2.7g,物质的量为
=0.15mol;氢元素质量为:0.3mol×1g/mol=0.3g,有机样品共3.1g,所以O元素物质的质量=3.1g-1.2g-0.3g=1.6g,氧原子物质的量为:
=0.1mol.
即3.1g有机物中n(C)=0.1mol,n(H)=0.15mol×2=0.3mol,n(O)=0.1mol,碳、氢、氧原子的物质的量之比为0.1mol:0.3mol:0.1mol=1:3:1,即最简式为CH3O,乙二醇分子式为C2H6O2,符合题意.
故选:A.
| 10g |
| 100g/mol |
| 2.7g |
| 18g/mol |
| 1.6g |
| 16g/mol |
即3.1g有机物中n(C)=0.1mol,n(H)=0.15mol×2=0.3mol,n(O)=0.1mol,碳、氢、氧原子的物质的量之比为0.1mol:0.3mol:0.1mol=1:3:1,即最简式为CH3O,乙二醇分子式为C2H6O2,符合题意.
故选:A.
点评:本题考查有机物分子式的确定,难度中等,根据质量守恒确定有机物的是否含有氧元素是关键,考查学生的解决问题的能力.

练习册系列答案
相关题目
20℃时,1L H2S的饱和溶液,浓度约为0.1mol?L-1,其电离方程式为:第一步 H2S?H++HS-;第二步 HS-?H++S2-.若要使该溶液的pH增大的同时,c(S2-)减小,可采用的措施是( )
①加入适量的NaOH溶液;②加入适量的水;③通入适量的SO2;④加入适量硫酸铜固体;⑤加入少量盐酸.
①加入适量的NaOH溶液;②加入适量的水;③通入适量的SO2;④加入适量硫酸铜固体;⑤加入少量盐酸.
| A、①③⑤ | B、②④⑤ |
| C、②③ | D、③④⑤ |
下列电离方程式中,正确的是( )
| A、Na2CO3=Na++CO32- |
| B、Ba(OH)2=Ba2++OH2- |
| C、H2SO4=H2++SO42- |
| D、NaCl=Na++Cl- |
| E、NaCl=Na++Cl- |
已知:NaCHO3在水溶液中水解的热化学方程式为:NaHCO3(aq)+H2O(l)?H2CO3(aq)+NaOH(aq)△H=+akJ?mol-1;稀盐酸和稀NaOH的中和热为bkJ?mol-1.则等物质的量的NaCHO3与稀盐酸反应的△H等于( )
| A、+(a+b)kJ?mol-1 |
| B、+(a-b)kJ?mol-1 |
| C、-(a-b)kJ?mol-1 |
| D、-(a+b)kJ?mol-1 |
下列化学实验操作或事故处理方法正确的是( )
| A、酒精灯着火时可用水扑灭 |
| B、为防止试管破裂,加热固体时试管口一般要略高于试管底 |
| C、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,边搅拌条件下边加入浓硫酸 |
下列说法不正确的是( )
| A、CCl4是由极性键构成的非极性分子 |
| B、胶体粒子可以透过滤纸但不能透过半透膜 |
| C、氯水中通入SO2气体发生反应,说明Cl2的氧化性强于S |
| D、需要加热才能发生的反应一定是吸热反应 |
参照反应Br+H2?HBr+H的能量对应反应历程的示意图,下列叙述中正确的是( )
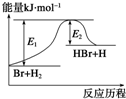

| A、正反应为吸热反应 |
| B、吸热反应一定要加热后才能发生 |
| C、反应物总能量高于生成物总能量 |
| D、升高温度可增大正反应速率,降低逆反应速率 |
下列有机物的命名正确的是( )
| A、3,3-二甲基丁烷 |
| B、3-甲基-2-乙基戊烷 |
| C、1,1-二氯乙烯 |
| D、2,3-二甲基戊烯 |