题目内容
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经5min时,测得D的浓度为0.5mol?L-1,c(A):c(B)=3:5,C的平均反应速率是0.1mol?(L?min)-1.回答下列各问题:
(1)5min内A的平均反应速率为 mol?(L?min)-1.
(2)x= .
(3)开始B的浓度为 mol?L-1.
(1)5min内A的平均反应速率为
(2)x=
(3)开始B的浓度为
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:利用三段式法解答,先设A、B的物质的量为nmol;D的浓度为0.5mol/L,所以D的物质的量为1mol.
设A、B的物质的量为nmol,
3A(g)+B(g)=xC(g)+2D(g),
开始(mol) n n 0 0
反应(mol) 1.5 0.5 1
5min(mol) n-1.5 n-0.5 1
c(A):c(B)=
:
=3:5,
所以n=3,
(1)根据A的浓度求出A的反应速率;
(2)根据D的浓度求出D的反应速率,C、D反应速率之比即为计量数之比,求出X;
(3)根据B的物质的量求出B的浓度.
设A、B的物质的量为nmol,
3A(g)+B(g)=xC(g)+2D(g),
开始(mol) n n 0 0
反应(mol) 1.5 0.5 1
5min(mol) n-1.5 n-0.5 1
c(A):c(B)=
| (n-1.5)mol |
| 2L |
| ( n-0.5)mol |
| 2L |
所以n=3,
(1)根据A的浓度求出A的反应速率;
(2)根据D的浓度求出D的反应速率,C、D反应速率之比即为计量数之比,求出X;
(3)根据B的物质的量求出B的浓度.
解答:
解:设A、B的物质的量为nmol;D的浓度为0.5mol/L,所以D的物质的量为1mol.
设A、B的物质的量为nmol,
3A(g)+B(g)=xC(g)+2D(g),
开始(mol) n n 0 0
反应(mol) 1.5 0.5 1
5min(mol) n-1.5 n-0.5 1
c(A):c(B)=
:
=3:5,
所以n=3,
(1)5min内A的平均反应速率V=
=0.15mol(L?min)-1,故答案为:0.15;
(2)5min内D的反应速率为
=0.1mol(L?min)-1,C的平均反应速率是0.1mol?(L?min)-1,C、D反应速率之比即为计量数之比=1:1,所以X=2,
故答案为:2;
(3)开始B的浓度为C=
=1.5mol?L-1,故答案为:1.5.
设A、B的物质的量为nmol,
3A(g)+B(g)=xC(g)+2D(g),
开始(mol) n n 0 0
反应(mol) 1.5 0.5 1
5min(mol) n-1.5 n-0.5 1
c(A):c(B)=
| (n-1.5)mol |
| 2L |
| ( n-0.5)mol |
| 2L |
所以n=3,
(1)5min内A的平均反应速率V=
| ||
| 5min |
(2)5min内D的反应速率为
| ||
| 5min |
故答案为:2;
(3)开始B的浓度为C=
| 3mol |
| 2L |
点评:本题考查化学平衡的计算,题目难度中等,注意计算中常见的错误:1.忽视体积因素,用某物质的物质的量的变化量除以时间的变化量计算;2.用一段时间后某物质的物质的量浓度除以时间的变化量直接计算.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列化学实验操作或事故处理方法正确的是( )
| A、酒精灯着火时可用水扑灭 |
| B、为防止试管破裂,加热固体时试管口一般要略高于试管底 |
| C、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,边搅拌条件下边加入浓硫酸 |
下列实验方案正确且能达到相应实验预期目的是( )
A、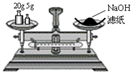 称量氢氧化钠固体 |
B、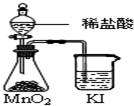 比较MnO2、Cl2、I2的氧化性 |
C、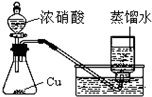 制取少量NO2 |
D、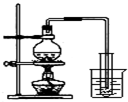 实验室制取蒸馏水 |
下列与化学反应能量变化相关的叙述中正确的是( )
| A、已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802 kJ/mol,甲烷的燃烧热为802 kJ/mol |
| B、等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多 |
| C、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
| D、由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 |
下列由相关实验现象所推出的结论正确的是( )
| A、氯气、二氧化硫均能使品红溶液褪色,说明二者均有氧化性 |
| B、铁与稀硝酸,稀硫酸反应均有气泡产生,说明铁与两种酸均能发生置换反应 |
| C、向溶液中滴加酸化的硝酸钡溶液出现白色沉淀,说明该溶液中一定有硫酸根离子 |
| D、分别充满氯化氢气体,氨气的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |