题目内容
20.下列说法或表示方法中正确的是( )| A. | 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1>△H2 | |
| B. | 由C(石墨)→C(金刚石)△H=+1.9kJ/mol,可知金刚石比石墨稳定 | |
| C. | 已知在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量.则有关氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=+285.8kJ/mol | |
| D. | 在稀溶液中,H+ (aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol硫酸的浓硫酸与含1 molNaOH的溶液混合,放出的热量大于57.3 kJ |
分析 A.根据气体变成固体放热判断;
B.石墨能量比金刚石小,较稳定;
C.反应放热,△H<0;
D.浓硫酸稀释放热.
解答 解:A.固体硫变为硫蒸汽要吸热,所以固体硫燃烧时放出的热量较少,则等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1<△H2,故A错误;
B.由C(石墨)→C(金刚石);△H=+1.9KJ/mol,可知反应为吸热反应,则石墨能量比金刚石小,能量越低越稳定,所以石墨比金刚石稳定,故B错误;
C.氢气的燃烧反应为放热反应,所以△H=-285.8kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-285.8KJ/mol,故C错误;
D.若将含0.5 mol硫酸的浓硫酸与含1 molNaOH的溶液混合,则酸碱中和放出的热量为57.3KJ,但由于浓硫酸稀释放热,故总体上来讲放出的热量大于57.3KJ,故D正确.
故选D.
点评 本题考查反应热与焓变,注意相关基础知识的积累,注意把握问题的角度,理解物质的聚集状态与能量的关系、稳定的大小比较等问题.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
10.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L CCl4的分子数约为NA个 | |
| B. | 常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA | |
| C. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| D. | 高温高压下,28gN2与6gH2反应,生成的NH3分子数为2nA |
8.某元素的最高正价和最低负价的绝对值相等,其最高价氧化物的式量与其气态氢化物的式量之比是11:4,该元素的最高价氧化物形成的晶体是( )
| A. | 分子晶体 | B. | 离子晶体 | C. | 原子晶体 | D. | 以上晶体都不是 |
15.有机物 的名称为( )
的名称为( )
 的名称为( )
的名称为( )| A. | 3,4-二甲基戊烷 | B. | 1-甲基-2-乙基丁烷 | ||
| C. | 2,3-二甲基戊烷 |
5.下列离子方程式正确的是( )
| A. | 硫酸铜和铝:2Al+3Cu2+═3Cu+2Al3+ | |
| B. | 氧化铜与盐酸反应:O2-+2H+═H2O | |
| C. | 碳酸钡与盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | Cu(OH)2加入H2SO4:2H++Cu(OH)2═Cu2++2H2O |
12.下列反应中,不属于四种基本类型反应,但属于氧化还原反应的是( )
| A. | 2CO+O2═2CO2 | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | 2KClO3═2KCl+3O2↑ | D. | Fe2O3+3CO═2Fe+3CO2 |
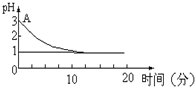 关于“电解氯化铜溶液时的pH值变化”问题,化学界有以下两种不同的观点:
关于“电解氯化铜溶液时的pH值变化”问题,化学界有以下两种不同的观点: