题目内容
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A、1mol Na加热时与O2反应失去的电子数目为NA |
| B、92g N2O4和92g NO2含有的原子数均为6NA |
| C、1L 0.1mol?L-1的盐酸中,所含HCl分子数为0.1NA |
| D、标准状况下,22.4L O3中含3NA个氧原子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.钠为1价金属,1mol钠完全反应,无论生成氧化钠还是过氧化钠,都失去1mol电子;
B.N2O4和NO2分子中N、O元素的含量相同,则等质量时含有的原子数一定相等;
C.氯化氢为强电解质,溶液中完全电离出氢离子和氯离子,溶液中不存在氯化氢分子;
D.标准状况下,22.4L臭氧的物质的量为1mol,含有3mol氧原子.
B.N2O4和NO2分子中N、O元素的含量相同,则等质量时含有的原子数一定相等;
C.氯化氢为强电解质,溶液中完全电离出氢离子和氯离子,溶液中不存在氯化氢分子;
D.标准状况下,22.4L臭氧的物质的量为1mol,含有3mol氧原子.
解答:
解:A.1mol钠完全反应,失去的电子一定为1mol,失去的电子数目为NA,故A正确;
B.92g N2O4和92gNO2都只有最简式NO22mol,都含有6mol原子,含有的原子数均为6NA,故B正确;
C.1L 0.1mol?L-1的盐酸中含有溶质氯化氢0.1mol,由于氯化氢为强电解质,溶液中不存在氯化氢分子,故C错误;
D.标况下22.4L臭氧的物质的量为1mol,1mol臭氧含有3mol氧原子,含3NA个氧原子,故D正确;
故选C.
B.92g N2O4和92gNO2都只有最简式NO22mol,都含有6mol原子,含有的原子数均为6NA,故B正确;
C.1L 0.1mol?L-1的盐酸中含有溶质氯化氢0.1mol,由于氯化氢为强电解质,溶液中不存在氯化氢分子,故C错误;
D.标况下22.4L臭氧的物质的量为1mol,1mol臭氧含有3mol氧原子,含3NA个氧原子,故D正确;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好分子、原子、原子核内质子中子及核外电子的构成关系,选项C为易错点,注意氯化氢在溶液中不存在氯化氢分子;试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
下列化学用语错误的是( )
A、氟离子的结构示意图: |
B、-CH3的电子式: |
C、Na+的电子排布图: |
| D、Na的简化电子排布式:[Ne]3s1 |
下列说法不正确的是( )
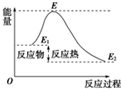

| A、反应物分子(或离子)间的每次碰撞是反应的先决条件 |
| B、反应物的分子的每次碰撞都能发生化学反应 |
| C、活化分子具有比普通分子更高的能量,催化剂能够减低活化能的数值 |
| D、活化能是活化分子的平均能量与所有分子平均能量之差,如图所示正反应的活化能为E-E1 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA |
| C、在常温常压下,11.2 L Cl2含有的分子数为0.5 NA |
| D、标准状况下,11.2 L H2O含有的分子数为0.5 NA |
下列化学用语或表达式正确的是( )
| A、Na+的电子排布式:1S22S22P6 |
| B、乙烯的结构简式CH2CH2 |
C、N原子最外层轨道表示式: |
D、 |
青霉素V钾的化学结构式为 下列有关说法错误的是( )
下列有关说法错误的是( )
 下列有关说法错误的是( )
下列有关说法错误的是( )| A、青霉素V钾为芳香族化合物 |
| B、青霉素V钾的分子式为C16H17KN2O5 |
| C、青霉素V钾在酸性条件下最终生成青霉氨基酸 |
| D、使用本品前需先进行青霉素皮肤敏感试验 |

 铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题:
铜和镍是第四周期重要的过渡元素,它们的单质及化合物具有广泛用途,请回答以下问题: ④HCHO,其中碳原子采取sp2杂化的分子有
④HCHO,其中碳原子采取sp2杂化的分子有