题目内容
下列离子方程式正确的是( )
| A、Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、氧化亚铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
| D、氢氧化铁与足量的氢碘酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、次氯酸是弱酸不能完全电离;
B、酸式盐和碱反应,量少的全部反应,离子方程式中符合化学式组成比;
C、氧化亚铁是氧化物不能拆成离子;
D、碘化氢具有还原性被三价铁离子氧化为碘单质.
B、酸式盐和碱反应,量少的全部反应,离子方程式中符合化学式组成比;
C、氧化亚铁是氧化物不能拆成离子;
D、碘化氢具有还原性被三价铁离子氧化为碘单质.
解答:
解:A、次氯酸是弱酸不能完全电离,Cl2通入水中:Cl2+H2O=H++Cl-+HClO,故A错误;
B、酸式盐和碱反应,量少的全部反应,离子方程式中符合化学式组成比,Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O,故B正确;
C、氧化亚铁是氧化物不能拆成离子,氧化亚铁溶于稀硝酸:3FeO+10H++NO3-═3Fe3++NO↑+5H2O,故C错误;
D、碘化氢具有还原性被三价铁离子氧化为碘单质,氢氧化铁与足量的氢碘酸溶液反应:2Fe(OH)3+2I-+6H+=2Fe2++6H2O+I2,故D错误;
故选B.
B、酸式盐和碱反应,量少的全部反应,离子方程式中符合化学式组成比,Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O,故B正确;
C、氧化亚铁是氧化物不能拆成离子,氧化亚铁溶于稀硝酸:3FeO+10H++NO3-═3Fe3++NO↑+5H2O,故C错误;
D、碘化氢具有还原性被三价铁离子氧化为碘单质,氢氧化铁与足量的氢碘酸溶液反应:2Fe(OH)3+2I-+6H+=2Fe2++6H2O+I2,故D错误;
故选B.
点评:本题考查了离子方程式书写方法和注意问题,注意次氯酸是弱酸,铁离子具有氧化性氧化碘离子,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是 ( )
| A、不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗 |
| B、甲、乙两种有机物具有相同的相对分子质量和不同结构,则甲和乙一定是同分异构体 |
| C、浓溴水滴入苯酚溶液中立即产生2,4,6-三溴苯酚的白色沉淀 |
| D、溴的苯溶液中加少量铁粉后会剧烈反应,并放出大量的热,但该现象不能说明苯和溴的取代反应就是放热反应 |
| E、分离沸点相差30℃以上的混溶液体,应采用的方法是蒸馏 |
| F、实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃ |
| G、除去混在苯中的少量苯酚,加入过量溴水,过滤 |
具有相同电子层结构的三种粒子A2+、B2-、C-.下列分析正确的是( )
| A、原子序数关系是A>C>B |
| B、离子半径关系是B2-<A2+ |
| C、C一定是稀有气体元素的一种原子 |
| D、原子半径关系是A<C<B |
如图各个装置中能组成原电池的是( )
A、 稀硫酸 |
B、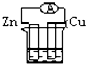 CuSO4溶液 |
C、 酒精溶液 |
D、 稀硫酸 稀硫酸 |
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、1.0 L 1.0 mo1?L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| B、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| C、25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| D、1mol的-OH与1 mol的OH-所含电子数均为9NA |
下列实验操作正确的是( )
| A、将氢氧化钠放在滤纸上称量 |
| B、用托盘天平称取1.06 g碳酸钠固体 |
| C、用浓硫酸配制一定物质的量浓度的稀硫酸溶液时,在量筒中稀释浓硫酸 |
| D、配制一定物质的量浓度溶液时,不能在容量瓶中直接进行溶解或稀释 |
浓硫酸与下列物质反应时,既表现酸性,又表现氧化性的是( )
| A、铜 | B、过氧化钠 | C、氧化铝 | D、碳 |