题目内容
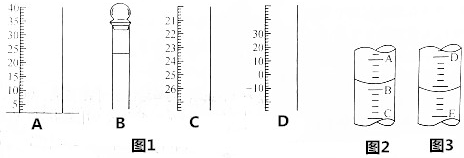
4. 某离子反应涉及H2O、CLO-、NH4+、H+、N2、CL-六种微粒.常温条件下反应时,溶液pH随时间变化的曲线如图所示,下列判断错误的是( )
某离子反应涉及H2O、CLO-、NH4+、H+、N2、CL-六种微粒.常温条件下反应时,溶液pH随时间变化的曲线如图所示,下列判断错误的是( )| A. | 该反应的氧化剂是CLO- | |
| B. | 该反应中有两种离子生成 | |
| C. | 该反应生成1mol氧化产物时,转移的电子为6mol | |
| D. | 参加反应的氧化剂与还原剂的物质的量之比为2:3 |
分析 由曲线变化图可知,随反应进行溶液pH减小,故氢离子是生成物,则NH4+应是反应物,N2是生成物N元素化合价发生变化,具有氧化性的ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,以此解答该题.
解答 解:方程式为3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,
A.具有氧化性的ClO-为反应物,充当氧化剂,故A正确;
B.由反应3ClO-+2NH4+=N2↑+3H2O+3Cl-+2H+,生成了氯离子和氢离子,故B正确;
C.N元素化合价由-3价升高到0价,则消耗1mol还原剂,转移3mol电子,故C错误;
D.由方程式可知氧化剂和还原剂的物质的量之比为3:2,故D错误.
故选CD.
点评 本题考查氧化还原反应的计算,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
14.下列实验方案不能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向1mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 除去甲烷中的乙烯 | 将混合气通入溴水洗气 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
| A. | A | B. | B | C. | C | D. | D |
15.已知某有机化合物的相对分子质量为128,且只由碳、氢两种元素组成.下列对该有机化合物的碳原子成键特点的分析中正确的是( )
| A. | 一定含有双键 | B. | 一定含有三键 | ||
| C. | 一定含有不饱和键 | D. | 可能含有苯环 |
12.下图实验方案能达到实验目的是( )
| A. |  测定氨盐纯度 | B. |  除去NO2并收集NO | ||
| C. |  分离四氯化碳和二氯甲烷 | D. |  验证中和反应是放热反应 |
16.用NA表示阿伏加德罗常数,N表示粒子数,下列说法正确的是( )
| A. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 1.6 g CH4含有共用电子对的数目为0.5NA | |
| D. | 100mLpH=2的新制氯水中,:N(OH-)+2N(ClO-)+N(HClO)=0.001NA |
6.对K2CO3分类,不正确的是( )
| A. | 属于钾盐 | B. | 属于碳酸盐 | C. | 属于正盐 | D. | 属于酸式盐 |