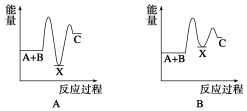
题目内容
7.实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗.正确的操作顺序是( )| A. | ①②③④⑤ | B. | ②④②③① | C. | ④②③① | D. | ②④①③ |
分析 根据粗苯中的成分及各试剂的作用分析,可溶性的物质易溶于水,所以用水洗涤易溶于水的物质;溴和氢氧化钠能反应所以可用氢氧化钠除去溴;干燥剂能吸收水分,利用物质沸点的不同可分离沸点不同的物质,据此进行排序.
解答 解:粗溴苯中含有苯、溴苯、溴化铁和溴,提纯时,为减少NaOH的用量,可先用水洗,可除去溴化铁和少量溴,然后加入10%的NaOH溶液洗涤,可除去溴,再用水洗除去碱液,经干燥后进行蒸馏可得溴苯,
所以正确的操作顺序为:②④②③①,
故选B.
点评 本题考查化学实验操作的先后顺序,为高频考点,题目难度不大,注意根据杂质的性质设计实验方案,特别是除杂时要注意满足除杂充分、操作简单.

练习册系列答案
相关题目
20.已知铍的原子序数为4,下列对铍及其化合物的叙述中,正确的是( )
| A. | 铍的金属性比钠强 | B. | 氯化铍的氧化性比氯化锂弱 | ||
| C. | 氢氧化铍的碱性比氢氧化钙弱 | D. | 单质铍易跟冷水反应生成H2 |
1.草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4•2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的目的是还原Fe3+、Co3+为Fe2+、Co2+.
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{{c({M{g^{2+}}})}}{{c({C{a^{2+}}})}}$=0.7.
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,在滤液II中适宜萃取的pH为3.0~3.5左右.
(6)已知:NH3•H2O?NH4++OH- Kb=1.8×10-5;
H2C2O4?H++HC2O4- Ka1=5.4×10-2;HC2O4-?H+C2O42- Ka2=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4(或CoO•Co2O3)


已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液$\frac{{c({M{g^{2+}}})}}{{c({C{a^{2+}}})}}$=0.7.
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,在滤液II中适宜萃取的pH为3.0~3.5左右.
(6)已知:NH3•H2O?NH4++OH- Kb=1.8×10-5;
H2C2O4?H++HC2O4- Ka1=5.4×10-2;HC2O4-?H+C2O42- Ka2=5.4×10-5
a.1 b.2 c.3 d.4
则该流程中所用(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”)
(7)CoC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是Co3O4(或CoO•Co2O3)

12.能正确表示下列反应的离子方程式是( )
| A. | Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
19.一定条件下,实验室利用右图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )

| A. | 该装置工作时化学能转化为电能 | B. | 左池中的银电极作正极 | ||
| C. | 总反应为Ag++Cl-═AgCl↓ | D. | 盐桥中的K+向右池方向移动 |
16.在一个可逆反应CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O中,向反应混合物中加入H218O后,重新达到平衡后,反应混合物中存在18O的说法正确的是( )
| A. | 只有H2O | |
| B. | 只有H2O、CH3COOH | |
| C. | 只有H2O、CH3CH2OH | |
| D. | CH3COOH、CH3CH2OH、CH3COOCH2CH3和H2O中都有 |
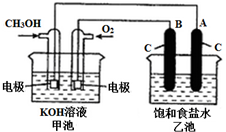 甲醇是一种可再生能源,具有广泛的开发和应用前景.图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
甲醇是一种可再生能源,具有广泛的开发和应用前景.图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O