题目内容
20.已知铍的原子序数为4,下列对铍及其化合物的叙述中,正确的是( )| A. | 铍的金属性比钠强 | B. | 氯化铍的氧化性比氯化锂弱 | ||
| C. | 氢氧化铍的碱性比氢氧化钙弱 | D. | 单质铍易跟冷水反应生成H2 |
分析 已知铍的原子序数为4,最外层电子数为2,与Mg、Ca同主族,性质相似,以此来解答.
解答 解:A.由周期表的位置及周期律可知,金属性Na>Mg>Be,故A错误;
B.金属性Li>Be,则氯化铍的氧化性比氯化锂强,故B错误;
C.金属性Ca>Be,则氢氧化铍的碱性比氢氧化钙弱,故C正确;
D.Mg与冷水反应较慢,则单质铍不易跟冷水反应生成H2,故D错误;
故选C.
点评 本题考查周期表的结构及应用,为高频考点,把握元素的位置、元素周期律是解本题关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
13.已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是( )
| A. | Z、Y、X、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| D. | 若X?Y?W组成的简单离子电子层结构相同,则W离子半径最大. |
8. 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.
(1)写出W的原子结构示意图: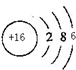 .
.
(2)已知:
①X(s)+O2(g)=XO2(g)△H=-393.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242.0kJ•mol-1
③XH4(g)+2O2(g)=XO2(g)+2H2O(g)△H=-802.0kJ•mol-1
则XH4气体分解成氢气和X固体的热化学方程式为CH4(g)=2H2(g)+C(s)△H=+75.5kJ/mol.
(3)ZO是由单质X和ZO2反应制取单质Z的中间产物(空气中极不稳定).隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为2SiO+2NaOH=Si+Na2SiO3+H2O.
(4)元素Y的Ca盐和H2为原料,反应产物只有甲和乙两种且均为化合物.研究发现:化合物甲的组成中钙、元素Y的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性.则乙的化学式为HCl;甲与水反应可得H2,其化学方程式是:2CaHCl+2H2O=CaCl2+Ca(OH)2+2H2↑.
(5)将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发).
①O点溶液中所含溶质的化学式为NaOH、Na2S.
②a点溶液中,c(Na+):c(Cl-)=5:3.
 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.| X | |||
| Z | W | Y |
 .
.(2)已知:
①X(s)+O2(g)=XO2(g)△H=-393.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242.0kJ•mol-1
③XH4(g)+2O2(g)=XO2(g)+2H2O(g)△H=-802.0kJ•mol-1
则XH4气体分解成氢气和X固体的热化学方程式为CH4(g)=2H2(g)+C(s)△H=+75.5kJ/mol.
(3)ZO是由单质X和ZO2反应制取单质Z的中间产物(空气中极不稳定).隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为2SiO+2NaOH=Si+Na2SiO3+H2O.
(4)元素Y的Ca盐和H2为原料,反应产物只有甲和乙两种且均为化合物.研究发现:化合物甲的组成中钙、元素Y的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性.则乙的化学式为HCl;甲与水反应可得H2,其化学方程式是:2CaHCl+2H2O=CaCl2+Ca(OH)2+2H2↑.
(5)将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发).
①O点溶液中所含溶质的化学式为NaOH、Na2S.
②a点溶液中,c(Na+):c(Cl-)=5:3.
15.有关原子轨道说法正确的是( )
| A. | 凡是中心原子采取sp3杂化轨道成键的分子,其空间立体结构都是正四面体 | |
| B. | 乙烯和苯分子每个碳原子都以sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 | |
| C. | 苯分子C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 | |
| D. | 凡是AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
5.在pH=13的无色溶液中,可以大量共存的一组离子是( )
| A. | NH4+、NO3-、K+、SO42- | B. | CO32-、NO3-、HCO3-、Na+ | ||
| C. | Na+、ClO-、AlO2-、NO3- | D. | Cu2+、K+、Na+、SO42- |
12.下列有关说法正确的是( )
| A. | 全部由非金属元素组成的化合物中只含共价键 | |
| B. | 同一主族元素的单质熔点从上到下依次升高 | |
| C. | 某种元素的相对原子质量取整数,就是其质量数 | |
| D. | 第ⅦA族元素的阴离子还原性随着原子序数的递增逐渐增强 |
9.甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低.能说明甲比乙的得电子能力强的是( )
| A. | ④ | B. | ⑤ | C. | ①②③ | D. | ①②③④ |
7.实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗.正确的操作顺序是( )
| A. | ①②③④⑤ | B. | ②④②③① | C. | ④②③① | D. | ②④①③ |

