题目内容
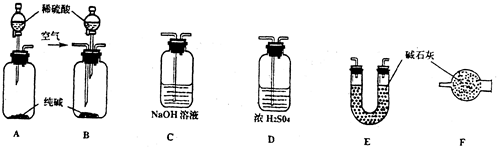
某课外活动小组在实验用如图所示的装置进行实验,测定氨分子中氮、氢原子个数之比.

实验时,用制得的氨气排尽装置中的空气后连接洗气瓶和气体收集装置,并立即加热氧化铜.反应完成后,黑色的氧化转化为红色的铜.请回答下列问题:
(1)写出仪器a的名称: .
(2)装置B和D中的药品相同,你认为是 .
(3)写出另一种实验室制备氨气的化学方程式: .
(4)根据上述实验原理,甲、乙两组同学分别设计了一种实验方案测定氨分子中氮、氢的原子个数之比:
甲小组用所测数据计算出氨分子中氮、氢原子个数之比为 ;乙小组用所测数据计算出氨分子中氮、氢原子个数之比为 ,则m4表示的是 .

实验时,用制得的氨气排尽装置中的空气后连接洗气瓶和气体收集装置,并立即加热氧化铜.反应完成后,黑色的氧化转化为红色的铜.请回答下列问题:
(1)写出仪器a的名称:
(2)装置B和D中的药品相同,你认为是
(3)写出另一种实验室制备氨气的化学方程式:
(4)根据上述实验原理,甲、乙两组同学分别设计了一种实验方案测定氨分子中氮、氢的原子个数之比:
| 实验数据1 | 实验数据2 | 实验数据3 | |
| 甲组 | 反应前氧化铜的质量 为m1g | 氧化铜反应后剩余固体的质量为m2g | 生成的氮气在标准状况下的体积为V1L |
| 乙组 | 实验前装置D的质量 为m3g | m4g | 生成的氮气在标准状况下的体积为V2L |
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)结合装置图中仪器图形和作用书写仪器名称;
(2)装置图是制备氨气的装置,氨气是碱性气体用碱石灰干燥;
(3)装置中制备氨气是利用分液漏斗中液体滴入烧瓶得到,反应不需要加热,实验室也可以利用氯化铵和氢氧化钙混合加热得到;
(4)甲组实验中氧化铜和氨气反应生成铜、氮气和水,结合氮原子守恒利用氮气物质的量计算氮原子物质的量,利用氧元素守恒,氧化铜反应前后质量变化是氧元素质量变化,计算水的物质的量,得到氢原子物质的量;乙组中m4和m3质量变化为生成水的质量,依据氮元素、氢元素守恒计算;
(2)装置图是制备氨气的装置,氨气是碱性气体用碱石灰干燥;
(3)装置中制备氨气是利用分液漏斗中液体滴入烧瓶得到,反应不需要加热,实验室也可以利用氯化铵和氢氧化钙混合加热得到;
(4)甲组实验中氧化铜和氨气反应生成铜、氮气和水,结合氮原子守恒利用氮气物质的量计算氮原子物质的量,利用氧元素守恒,氧化铜反应前后质量变化是氧元素质量变化,计算水的物质的量,得到氢原子物质的量;乙组中m4和m3质量变化为生成水的质量,依据氮元素、氢元素守恒计算;
解答:
解:(1)结合装置图中仪器图形和作用书写仪器名称,装置图中a为分液漏斗;
故答案为:分液漏斗;
(2)装置图是制备氨气的装置,装置B和D中的药品相同,氨气是碱性气体用碱石灰干燥,也可以吸收水蒸气;
故答案为:碱石灰;
(3)装置中制备氨气是利用分液漏斗中液体滴入烧瓶得到,反应不需要加热,实验室也可以利用氯化铵和氢氧化钙混合加热得到,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(4)甲组实验中氧化铜和氨气反应生成铜、氮气和水,结合氮原子守恒利用氮气物质的量计算氮原子物质的量,利用氧元素守恒,氧化铜反应前后质量变化是氧元素质量变化,计算水的物质的量,得到氢原子物质的量;反应前氧化铜的质量为m1g,氧化铜反应后剩余固体的质量为m2g,反应前后质量变化为生成水中氧元素质量,则氢元素物质的量依据氧元素物质的量计算,n(H)=
×2,生成的氮气在标准状况下的体积为V1L,氮元素物质的量n(N)=
×2
氨分子中氮、氢原子个数之比=
×2:
×2=
;
乙组中m4和m3质量变化为生成水的质量,依据氮元素、氢元素守恒计算,氮元素物质的量n(N)=
×2,水的质量为m4-m3,所含氢元素物质的量=
×2,乙小组用所测数据计算出氨分子中氮、氢原子个数之比=
×2:
×2=
,则m4表示的是实验后装置D的质量;
故答案为:
;
;实验后装置D的质量;
故答案为:分液漏斗;
(2)装置图是制备氨气的装置,装置B和D中的药品相同,氨气是碱性气体用碱石灰干燥,也可以吸收水蒸气;
故答案为:碱石灰;
(3)装置中制备氨气是利用分液漏斗中液体滴入烧瓶得到,反应不需要加热,实验室也可以利用氯化铵和氢氧化钙混合加热得到,反应的化学方程式为:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(4)甲组实验中氧化铜和氨气反应生成铜、氮气和水,结合氮原子守恒利用氮气物质的量计算氮原子物质的量,利用氧元素守恒,氧化铜反应前后质量变化是氧元素质量变化,计算水的物质的量,得到氢原子物质的量;反应前氧化铜的质量为m1g,氧化铜反应后剩余固体的质量为m2g,反应前后质量变化为生成水中氧元素质量,则氢元素物质的量依据氧元素物质的量计算,n(H)=
| m1-m2 |
| 16 |
| V1 |
| 22.4 |
氨分子中氮、氢原子个数之比=
| V1 |
| 22.4 |
| m1-m2 |
| 16 |
| 5V1 |
| 7(m1-m2) |
乙组中m4和m3质量变化为生成水的质量,依据氮元素、氢元素守恒计算,氮元素物质的量n(N)=
| V2 |
| 22.4 |
| m4-m3 |
| 18 |
| V2 |
| 22.4 |
| m4-m3 |
| 18 |
| 45V2 |
| 56(m4-m3) |
故答案为:
| 5V1 |
| 7(m1-m2) |
| 45V2 |
| 56(m4-m3) |
点评:本题考查了物质组成的实验探究方法和实验过程分析计算,掌握基础是关键,题目难度中等.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S
6Cu+SO2; 对于该反应,下列说法中错误的是( )
| ||
| A、反应中Cu2S只做氧化剂 |
| B、还原产物与氧化产物的物质的量之比为6:1 |
| C、Cu2O在反应中具有氧化性 |
| D、反应中被氧化的元素是S |
设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、18gNH4+中含有的电子数为10NA |
| B、常温常压下,10g氖气所含原子数为NA |
| C、1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA |
| D、标准状况下,2.24L己烷含有分子的数目为0.1NA |
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和天然气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体;⑧合金的熔点比它的各成分的熔点高、合金的硬度和强度一般比纯金属低⑨Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂.上述说法正确的是( )
| A、①③④⑧ | B、①②⑥⑨ |
| C、③⑤⑥⑦ | D、①③④⑦ |
下列气体属于温室效应气体的是( )
| A、CO2 |
| B、N2O |
| C、CH4 |
| D、N2 |

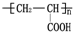 的单体,则A中所含官能团的名称是
的单体,则A中所含官能团的名称是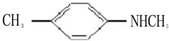 、
、

 是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2 及
是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2 及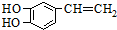 为原料制备该化合物,合成该化合物路线流程图(无机试剂任用),
为原料制备该化合物,合成该化合物路线流程图(无机试剂任用),