题目内容
13.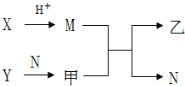 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )| A. | 相对分子质量M>N,沸点N>M | |
| B. | A、C、D的常见氧化物相互之间一定能反应 | |
| C. | 简单离子半径:C2->B2->D+>A+ | |
| D. | D与其他元素均能形成离子化合物 |
分析 A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质,Y与乙均为淡黄色固体,则乙为S,Y为Na2O2,Y能与N反应生成甲为O2,硫与氧气摩尔质量均为32g/mol.X与Y的摩尔质量相等,均为78g/mol,且X与酸反应生成M,M与氧气反应生成二氧化硫与N,可推知M为H2S,N为H2O,X为Na2S,故A为H元素、B为O元素、C为S元素、D为Na.
解答 解:A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质,Y与乙均为淡黄色固体,则乙为S,Y为Na2O2,Y能与N反应生成甲为O2,硫与氧气摩尔质量均为32g/mol.X与Y的摩尔质量相等,均为78g/mol,且X与酸反应生成M,M与氧气反应生成二氧化硫与N,可推知M为H2S,N为H2O,X为Na2S,故A为H元素、B为O元素、C为S元素、D为Na.
A.M为H2S,N为H2O,硫化氢相对分子质量大于水的,水分子之间存在氢键,硫化氢的沸点低于水的,故A正确;
B.过氧化氢不能与三氧化硫反应,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径S2->O2->Na+>H+,故C正确;
D.Na能与H形成NaH、与氧元素形成氧化钠、过氧化钠,与硫元素形成硫化钠,均属于离子化合物,故D正确.
故选:B.
点评 本题考查无机物推断,“物质的颜色及均由短周期元素组成”为推断突破口,基本属于猜测验证型题目,熟练掌握元素化合物性质,注意识记一些特殊的相对分子质量质量,难度较大.

练习册系列答案
相关题目
3.甲苯( )分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
)分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
 )分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
)分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )| A. | 8种 | B. | 12种 | C. | 10种 | D. | 16种 |
4.下列图中的实验方案,能达到实验目的是( )
| A | B | |
| 实验 方案 |  |  |
| 实验 目的 | 比较不同催化剂对同一反应速率的影响 | 证明:Ksp(AgCl)>Ksp(AgI) |
| C | D | |
| 实验 方案 |  |  |
| 实验 目的 | 除去CO2气体中混有的SO2 | 证明铁钉生锈过程中有氧气参与反应 |
| A. | A | B. | B | C. | C | D. | D |
1.化学与社会、生活、生产联系广泛.下列说法正确的是( )
| A. | 高铁酸钾处理水的原理与明矾完全相同 | |
| B. | 推广煤的气化和液化技术,能减少二氧化碳的排放 | |
| C. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料 | |
| D. | 食品安全包括限制添加剂的种类和添加的量 |
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数月为3NA | |
| B. | 标准状况下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1 mol NaBH4中离子键的数目为2NA | |
| D. | 在K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O中,若生成71 g Cl2,转移的电子数目为NA |
18.下列图中的实验方案,能达到实验目的是( )
| 实验方案 | A | B | C | D |
| 图 | 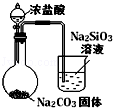 | 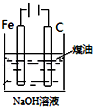 | 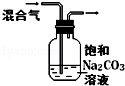 | 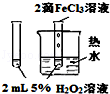 |
| 实验目的 | 比较HCl、H2CO3和H2SiO3的酸性强弱 | 制备Fe(OH)2并能较长时间观察其颜色 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2分解反应有催化作用 |
| A. | A | B. | B | C. | C | D. | D |
5.下列说法正确的是( )
| A. | 环己醇分子中所有的原子可能共平面 | |
| B. | 按系统命名法,(CH3CH2)2CHCH3化合物的名称是3-乙基丁烷 | |
| C. | 芳香化合物A(C8H8O3)分子中含有酯基和醚键两种含氧官能团,A可能的同分异构体有4种 | |
| D. | 在一定条件下,1.0 mol的 最多能与含4.0 mol NaOH的溶液完全反应 最多能与含4.0 mol NaOH的溶液完全反应 |

 (1)等质量的O2、CH4、H2的物质的量的比值为1:2+16.
(1)等质量的O2、CH4、H2的物质的量的比值为1:2+16.