题目内容
18.下列图中的实验方案,能达到实验目的是( )| 实验方案 | A | B | C | D |
| 图 | 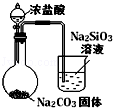 | 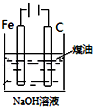 | 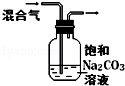 | 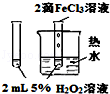 |
| 实验目的 | 比较HCl、H2CO3和H2SiO3的酸性强弱 | 制备Fe(OH)2并能较长时间观察其颜色 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2分解反应有催化作用 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓盐酸具有挥发性,生成的二氧化碳中含有HCl,HCl能和Na2SiO3反应生成H2SiO3;
B.Fe(OH)2不稳定,易被氧气氧化生成Fe(OH)3,所以制备Fe(OH)2时要隔绝空气;
C.CO2、SO2都能和碳酸钠反应;
D.验证FeCl3对H2O2分解反应有催化作用,应该只有催化剂不同,其它条件必须完全相同.
解答 解:A.浓盐酸具有挥发性,生成的二氧化碳中含有HCl,HCl能和Na2SiO3反应生成H2SiO3,干扰二氧化碳、水和硅酸钠的反应,所以将气体通入硅酸钠溶液中时要先除去HCl,故A错误;
B.Fe(OH)2不稳定,易被氧气氧化生成Fe(OH)3,所以制备Fe(OH)2时要隔绝空气,Fe失电子生成亚铁离子,亚铁离子和NaOH反应生成Fe(OH)2,溶液能隔绝空气,所以能实现实验目的,故B正确;
C.CO2、SO2都能和碳酸钠反应,应该用饱和的碳酸氢钠溶液除去二氧化硫,故C错误;
D.验证FeCl3对H2O2分解反应有催化作用,应该只有催化剂不同,其它条件必须完全相同,催化剂和温度两个因素不同,所以不能实现实验目的,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及反应速率影响因素的探究、物质制备、除杂、酸性强弱比较等知识点,明确实验原理、物质性质是解本题关键,注意除杂时要除去杂质、不能引进新的杂质且操作简便,易错选项是A.

练习册系列答案
相关题目
9.某温度时,在体积为2L的密闭容器中,气态物质A、B、E、F的物质量n随时间t的变化如图甲所示,在一定条件下达到平衡,反应进程中正反应速率随时间的倾谈情况如图乙所示,在t2、t4时刻分别只改一个条件(温度、压强或某反应物的量).下列说法错误的是( )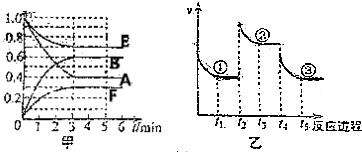

| A. | t2时刻可能是增大压强 | |
| B. | 平衡状态①和②,平衡常数K一定相同 | |
| C. | 平衡状态①、②和③中,状态③中F的浓度最大 | |
| D. | t4时刻改变的条件是降低温度 |
13.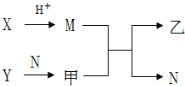 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
 已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )
已知A、B、C、D为短周期内原子半径依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是( )| A. | 相对分子质量M>N,沸点N>M | |
| B. | A、C、D的常见氧化物相互之间一定能反应 | |
| C. | 简单离子半径:C2->B2->D+>A+ | |
| D. | D与其他元素均能形成离子化合物 |
3.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| C. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 | |
| D. | 微粒直径为2.5微米的细小颗粒物与空气形成的分散系属于胶体 |
10. 有A、B、C、D四种含14个电子的粒子,其结构特点如下:
有A、B、C、D四种含14个电子的粒子,其结构特点如下:
(1)某元素的原子核外电子数比A元素原子核外电子数多2,则该元素在周期表中的位置为第三周期第VIA族.工业上常以焦炭、A元素的氧化物为原料制取单质A,用化学方程式表示其原理SiO2+2C $\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑.
(2)在101kPa,25℃时,42g B完全燃烧放出424.5kJ的热量,写出表示B的燃烧热的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol.
(3)32g 由D与钙离子组成的化合物中,含有的共用电子对数为9.03×1023.
(4)组成C的元素与另一短周期元素组成的分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间均以单键相连接.下列有关说法中错误的是C.
A.X原子为组成C的元素原子
B.该分子中,既含极性键,又含非极性键
C.Y原子可能为氢原子
D.从圆球的相对大小来分析,该分子可能为N2F4
(5)甲是组成C的元素最简单的气态氢化物.
①一定条件下,甲在恒容密闭容器中发生分解反应(正反应方向为吸热反应)并达平衡后,仅改变表中反应条件x,下列各项中y随x的增大而增大的是bc(填序号).
②甲与空气可以构成一种环保型燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 有A、B、C、D四种含14个电子的粒子,其结构特点如下:
有A、B、C、D四种含14个电子的粒子,其结构特点如下:| 粒子代码 | A | B | C | D |
| 原子核数目 | 单核 | 不同元素构成的两核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子所带电荷数 | 0 | 0 | 0 | 两个负电荷 |
(2)在101kPa,25℃时,42g B完全燃烧放出424.5kJ的热量,写出表示B的燃烧热的热化学方程式:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0 kJ/mol.
(3)32g 由D与钙离子组成的化合物中,含有的共用电子对数为9.03×1023.
(4)组成C的元素与另一短周期元素组成的分子的球棍模型如图所示.已知分子中所有原子的最外层均达到8电子稳定结构,原子间均以单键相连接.下列有关说法中错误的是C.
A.X原子为组成C的元素原子
B.该分子中,既含极性键,又含非极性键
C.Y原子可能为氢原子
D.从圆球的相对大小来分析,该分子可能为N2F4
(5)甲是组成C的元素最简单的气态氢化物.
①一定条件下,甲在恒容密闭容器中发生分解反应(正反应方向为吸热反应)并达平衡后,仅改变表中反应条件x,下列各项中y随x的增大而增大的是bc(填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
7.下列关于化学实验的说法正确的是( )
| A. | 分离物质的量之比为1:6的氯化钠和硝酸钾混合物时,可先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得到硝酸钾晶体;将母液加热至有大量晶体析出后,用余热蒸干,得氯化钠晶体 | |
| B. | 在“反应热的测量和计算”实验时须先将用于实验的等体积等物质的量的稀NaOH和稀HCl溶液置于相同温度(一般为25℃)下保温一段时间后再混合 | |
| C. | 在电化学实验中常使用碳电极,实验室一般采用多孔碳棒作为碳电极.有些电化学反应中的气体产物可以自由填充在多孔碳棒的疏松空隙中,从而降低反应池的极性,提高电流效率 | |
| D. | 在实验中观察到的物质的颜色可能会与其理论颜色有一定的偏差,如通过Cu和浓HNO3反应制得的Cu(NO3)2溶液中因溶有少量NO2而显黄色,苯酚因被空气中的O2氧化而显粉红色. |
 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:
a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题: 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题: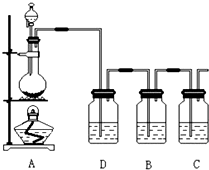 已知非金属单质硫(S)难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: