题目内容
16.下列说法中,不正确的是( )| A. | 光导纤维是信息社会必不可少的有机合成材料 | |
| B. | 食盐加碘实质是在食盐中加入KIO3 | |
| C. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 | |
| D. | 焚烧垃圾会产生大量污染空气的物质,故不宜采用此法 |
分析 A.光导纤维主要成分是二氧化硅,为无机物;
B.依据加碘盐中加的是碘酸钾解答;
C.陶瓷属于无机非金属材料;
D.焚烧垃圾会产生大量污染空气的物质,造成环境污染.
解答 解:A.光导纤维主要成分是二氧化硅,为无机物,属于无机非金属材料,故A错误;
B.加碘盐中加的是碘酸钾,故B正确;
C.航天飞机上的陶瓷防护片属于新型无机非金属材料,故C正确;
D.焚烧垃圾会产生大量污染空气的物质,造成环境污染,故不宜采用此法,故D正确;
故选:A.
点评 本题考查了生活中的化学,设计生活中常见的材料、环境污染与保护,题目难度不大,注意对基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.与100mL 0.1mol/L AlCl3溶液中Cl-离子浓度相同的是( )
| A. | 10mL 1mol/L FeCl3溶液 | B. | 50mL 0.3mol/L NaCl溶液 | ||
| C. | 10mL 0.2mol/L CaCl2溶液 | D. | 200mL 0.1mol/L NH4Cl溶液 |
1.某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如图:
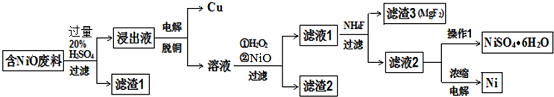
已知:有关金属离子生成氢氧化物沉淀所需的pH如表:
(1)滤渣1的主要成分为SiO2.
(2)从滤液2中获得NiSO4•6H2O的实验操作加热浓缩、冷却结晶、过滤、洗涤、干燥.
(3)用离子方程式解释加入H2O2的作用2H++H2O2+2Fe2+═2Fe3++2H2O.
(4)加NiO调节溶液的pH至5,则生成沉淀的离子方程式有2Fe3++3NiO+3H2O=2Fe(OH)3+3Ni2+、2Al3++3NiO+3H2O=2Al(OH)3+3Ni2+.
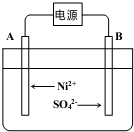
(5)电解浓缩后的滤液2可获得金属镍,其基本 反应原理如图:
①A电极反应式为Ni2++2e-=Ni和2H++2e-═H2↑.
②若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni29.5g.

已知:有关金属离子生成氢氧化物沉淀所需的pH如表:
| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.6 | 7.3 | 7.0 | 9.6 |
| 完全沉淀 | 3.8 | 4.7 | 9.3 | 9.0 | 12.0 |
(2)从滤液2中获得NiSO4•6H2O的实验操作加热浓缩、冷却结晶、过滤、洗涤、干燥.
(3)用离子方程式解释加入H2O2的作用2H++H2O2+2Fe2+═2Fe3++2H2O.
(4)加NiO调节溶液的pH至5,则生成沉淀的离子方程式有2Fe3++3NiO+3H2O=2Fe(OH)3+3Ni2+、2Al3++3NiO+3H2O=2Al(OH)3+3Ni2+.
(5)电解浓缩后的滤液2可获得金属镍,其基本 反应原理如图:
①A电极反应式为Ni2++2e-=Ni和2H++2e-═H2↑.
②若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni29.5g.

5.如图所示,将铁棒和石墨棒插入1L 1mol•L-1食盐水中.下列说法正确的是( )


| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与N连接,正极反应式是4OH--4e-═2H2O+O2↑ | |
| C. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| D. | 若电键K与M连接,当两极共产生22.4L(标准状况)气体时,生成了1mol NaOH |

 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: