题目内容
6. 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:(1)写出MOH的电离方程式:MOH═M++OH-
(2)MOH与HA恰好完全反应时,溶液呈碱性(填“酸”、“碱”或“中”),理由是(用离子方程式表示):A-+H2O?HA+OH-.
(3)D点时,溶液中c(A-)+c(HA)=2c(M+)(填“>”、“<”或“=”).
分析 (1)由图象可知0.1mol/L MOH溶液的pH=13,c(OH-)=0.1mol/L,说明为强碱,完全电离;
(2)由图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,溶液呈碱性;
(3)根据D点溶液中的物料守恒判断.
解答 解:(1)由图象可知0.1mol/L MOH溶液的pH=13,c(OH-)=0.1mol/L,说明为强碱,完全电离,则电离方程式为:MOH═M++OH-,
故答案为:MOH═M++OH-;
(2)由图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,水解呈碱性,水解的离子方程式为:A-+H2O?HA+OH-,
故答案为:碱;A-+H2O?HA+OH-;
(3)D点时,加入n(HA)=0.005mol,而加入n(MOH)=0.0025mol,A元素以A-和HA两种形式存在,而M全以M+形式存在,溶液中c(A-)+c(HA)=2c(M+),
故答案为:=.
点评 本题考查了酸碱混合溶液定性判断,题目难度中等,试题侧重于学生的分析能力的考查,为高考常见题型,明确图象中各个点的含义是解本题关键,结合物料守恒来分析解答,试题培养了学生的灵活应用能力.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
16.下列说法中,不正确的是( )
| A. | 光导纤维是信息社会必不可少的有机合成材料 | |
| B. | 食盐加碘实质是在食盐中加入KIO3 | |
| C. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 | |
| D. | 焚烧垃圾会产生大量污染空气的物质,故不宜采用此法 |
17.下列各组物质,前者逐滴滴加到后者中直至过量,先出现白色沉淀,后来沉淀又消失的是( )
| A. | H2SO4滴入NaAlO2溶液中 | B. | Ba(OH)2溶液滴入Al2(SO4)3溶液中 | ||
| C. | Al2(SO4)3溶液滴入NaOH溶液中 | D. | 氨水滴入Al2(SO4)3溶液中 |
1.等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则AlCl3和NaOH两种溶液物质的量浓度之比是( )
①1:3 ②1:4 ③2:3 ④2:7.
①1:3 ②1:4 ③2:3 ④2:7.
| A. | ③④ | B. | ①② | C. | ②④ | D. | ①③ |
11.下列有机物实际存在且命名正确的是( )
| A. | 2,2-二甲基丁烷 | B. | 2-甲基-5-乙基-1-己烷 | ||
| C. | 3-甲基-2-丁烯 | D. | 3,3-二甲基-2-戊烯 |
18.下列变化不能用勒夏特列原理解释的是( )
| A. | 红棕色的NO2气体加压后颜色先变深再变浅 | |
| B. | 打开汽水瓶,看到有大量的气泡逸出 | |
| C. | 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 | |
| D. | H2、I2、HI混合气体加压后颜色变深 |
15.工业合成氨是人工固氮方法之一.

I.已知下列物质的键能:
则N2(g)+3H2(g)?2nh3(g)△H=-92kJ/mol
Ⅱ恒温下,将一定量N2、H2置于10L的容器中发生反应,反应过程中各物质浓度随时间变化如图1.
(1)图1中0~2s内的反应速率v(H2)=0.75mol/(L.s);该温度下平衡常数的计算表达式为$\frac{(1.00mol/L)^{2}}{(1.5mol/L)^{3}•(1.00mol/L)}$.
(2)该反应达到平衡的标志为AD(填序号).
A.混合气体的平均相对分子质量不变
B.物质的量浓度比等于系数比
C.容器内温度不变
D.断裂1moIH-H键同时断裂2molN-H键
(3)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2)增大(填“增大”、“减小”、“不变’’或“不能确定”).
(4)哈伯研究所因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.
若用 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
①吸附后,能量状态最低的是C(填字母序号).
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图3.从吸附和解吸过程分析,c0前速率增加的原因可能是氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;c0后速率降低的原因可能是达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸.

I.已知下列物质的键能:
| N-N | N═N | N≡N | N-H | H-H |
| 193 KJ/mol | 418KJ/mol | 946KJ/mol | 391KJ/mol | 436KJ/mol |
Ⅱ恒温下,将一定量N2、H2置于10L的容器中发生反应,反应过程中各物质浓度随时间变化如图1.
(1)图1中0~2s内的反应速率v(H2)=0.75mol/(L.s);该温度下平衡常数的计算表达式为$\frac{(1.00mol/L)^{2}}{(1.5mol/L)^{3}•(1.00mol/L)}$.
(2)该反应达到平衡的标志为AD(填序号).
A.混合气体的平均相对分子质量不变
B.物质的量浓度比等于系数比
C.容器内温度不变
D.断裂1moIH-H键同时断裂2molN-H键
(3)若其它条件不变,将恒容条件变为恒压,则平衡时c(N2)增大(填“增大”、“减小”、“不变’’或“不能确定”).
(4)哈伯研究所因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.
若用
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:①吸附后,能量状态最低的是C(填字母序号).
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图3.从吸附和解吸过程分析,c0前速率增加的原因可能是氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;c0后速率降低的原因可能是达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸.
 分液.
分液.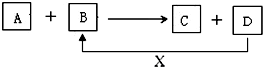 A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:
A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白: