题目内容
7.按要求完成下列填空:①相同质量的氢气、甲烷、水,其中含分子数最多的是氢气.
②4.9g H2SO4共含有0.35NA个原子.
③a个X原子的总质量为b g,则X的相对原子质量可表示为$\frac{b}{a}$NA.
分析 ①根据N=nNA=$\frac{m}{M}$NA分析;
②根据N=nNA=$\frac{m}{M}$NA计算出硫酸分子的个数,再根据一个硫酸分子中含有的氢原子数、原子总数求出氢原子的个数、原子总数;
③先计算出NA个X原子的质量,然后结合相对原子质量与摩尔质量的关系解答.
解答 解:①根据N=nNA=$\frac{m}{M}$NA可知,质量相同时摩尔质量越大,气体的含有分子数越多,氢气、甲烷、水三种物质中,氢气的相对分子质量最小,则氢气含有分子数最多,
故答案为:氢气;
②一个H2SO4分子中含有7个原子,4.9gH2SO4的物质的量为:$\frac{4.9g}{98g/mol}$=0.05mol,含有原子数目为:0.05mol×7×NA=0.35NA,
故答案为:0.35 NA;
③a个X原子的总质量为b g,NA个X原子的质量为:$\frac{bg}{a}$×NA,X原子的摩尔质量为$\frac{b}{a}$NAg/mol,则X的相对原子质量为$\frac{b}{a}$NA,
故答案为:$\frac{b}{a}$NA.
点评 本题考查物质的量的计算,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系即可解答,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列事实能说明金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应生成的阳离子,甲离子的化合价比乙高.
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应生成的阳离子,甲离子的化合价比乙高.
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②⑤可以 | D. | ①③④可以 |
4.下列说法正确的是( )
| A. | 0.1mol/L NH4Al(SO4)2溶液中离子浓度大小关系为c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1 HA(一元酸)溶液与0.1 mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)═c(OH-)+c(A-) | |
| C. | 将0.1 mol/L的醋酸溶液加水稀释的过程中,溶液里所有离子浓度都减小 | |
| D. | 向CaSO4和BaSO4沉淀共存的体系中加入少量BaCl2,溶液中c(Ca2+)减小 |
2.化学中常用图象直观地描述化学反应的进程或结果,下列图象描述正确的是( )

| A. | 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,且乙的压强大 | |
| C. | 图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 | |
| D. | 图④表示在2L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10min内该反应的平均速率v(H2)=0.045mol•L-1•min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为b |
12.在水中加入等物质的量的Na+、Ag+、Pb2+和SO42-、Cl-、NO3-,然后放入惰性材料做电极的电解槽中,通电片刻,则氧化产物与还原产物的质量比为 ( )
| A. | 35.5:108 | B. | 16:207 | C. | 8:1 | D. | 108:35.5 |
17.在下列环境中能大量共存的离子组是( )
| A. | 弱碱性溶液中 Na+、K+、Cl-、HCO3- | B. | 酸性溶液中 Na+、ClO-、SO42-、I- | ||
| C. | 无色溶液中 Al3+、NH4+、Cl-、OH- | D. | 无色溶液中 Fe3+、K+、Cl-、SCN- |
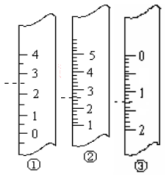 (1)如图分别是温度计、量筒、滴定管的一部分,则:温度计应该是①,读数是2.5℃,量筒应该是②,读数为2.5 mL,滴定管应该是③,读数为1.30 mL
(1)如图分别是温度计、量筒、滴定管的一部分,则:温度计应该是①,读数是2.5℃,量筒应该是②,读数为2.5 mL,滴定管应该是③,读数为1.30 mL